PFSおよびOSで標準治療の化学療法より優れた効果
Merck & Co., Inc., Kenilworth, N.J., U.S.A.(米国とカナダ以外ではMSD)は10月24日、抗PD-1抗体「キイトルーダ(R)」(一般名:ペムブロリズマブ)が、PD-L1高発現(TPS≧50%)でEGFRまたはALK遺伝子変異陰性の転移性非小細胞肺がん患者のファーストライン治療薬として、米国食品医薬品局(FDA)の承認を取得したと発表した。
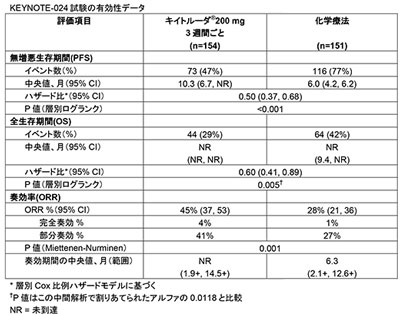
画像はリリースより
この承認は、扁平上皮(18%)および非扁平上皮(82%)の転移性非小細胞肺がん患者に対するキイトルーダの単独治療と標準治療(SOC)のプラチナ製剤を含む化学療法を比較した無作為化非盲検第3相臨床試験であるKEYNOTE-024試験のデータに基づいて行われた。この試験は、転移性疾患に対する全身化学療法を受けたことがなく、PD-L1を高発現(TPS≧50%)し、EGFRまたはALK遺伝子異常の見られない患者を対象として実施。患者305例は、キイトルーダ群(3週間ごとに200mg)と、標準治療のプラチナ製剤化学療法のうち治験責任医師が選択する化学療法群に無作為に割り付けられた。
その結果、中間解析においてキイトルーダが主要評価項目の無増悪生存期間(PFS)および副次評価項目の全生存期間(OS)において化学療法より優れた効果を示したことから、治験は2016年6月上旬に中止され、化学療法を受けている患者もキイトルーダによる治療を受けることが可能になっている。
セカンドライン以降の治療に関する試験データも添付文書に記載
また今回、PD-L1発現陽性(TPS≧1%)で、プラチナ製剤を含む化学療法の治療中または治療後に疾患進行が認められた転移性非小細胞肺がん患者に対するセカンドライン以降の治療に関するKEYNOTE-010試験のデータを添付文書に記載することについてもFDAの承認を取得したという。
EGFRまたはALK遺伝子変異陽性患者は、プラチナ製剤を含む化学療法に加えて、FDAが承認する遺伝子変異を対象とした治療で疾患進行が認められた場合にキイトルーダの使用が可能となる。
なお国内では、キイトルーダは今年9月28日に根治切除不能な悪性黒色腫に対する効能・効果について製造販売承認を取得。2月29日には、切除不能な進行または再発の非小細胞肺がんを効能・効果としての承認申請を行い、さらにKEYNOTE-024試験データをもとに進行性非小細胞肺がん患者に対するファーストライン治療についても審査中だ。
また同剤の臨床試験では、膀胱がん、肺がん、乳がん、大腸がん、食道がん、胃がん、頭頸部がん、多発性骨髄腫、ホジキンリンパ腫、肝がん、卵巣がん、前立腺がんなどを対象とした後期臨床試験が進行中。2015年には、治癒切除不能な進行・再発の胃がんに対する効能・効果について、厚生労働省から「先駆け審査指定制度」施行後初めての対象品目のひとつに指定されている。
▼関連リンク
・MSD株式会社 ニュースリリース




