アルツハイマー病や中枢神経再生阻害のメカニズム解明に
横浜市立大学は10月31日、同大大学院医学研究科 分子薬理神経生物学の中村史雄准教授、五嶋良郎教授らの研究グループが神経ガイド分子のセマフォリン3Aについて、アクチン骨格を制御する分子メカニズムを新たに解明したことを明らかにした。
画像はプレスリリースより
この研究成果は、東京女子医科大学、横浜国立大学との共同研究によるもの。アルツハイマー病や、神経軸索再生阻害の機構を解明することにつながるものとして注目される。論文は、英科学雑誌「Nature Communications」オンライン版に10月31日付で掲載されている。
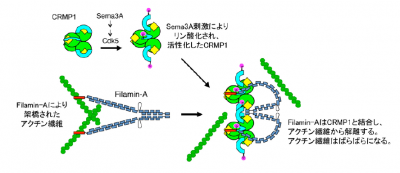
神経ガイド分子の反発因子のひとつであり、神経の伸びを阻害するセマフォリン3A(Sema3A)については、これまでに成長円錐のアクチン骨格の崩壊を引き起こし、神経突起の伸長を反発・阻害する作用を持つことが明らかになっている。同研究グループは、すでにSema3Aの反発作用において、CRMP1という細胞内タンパク質の関与があることを指摘してきた。だが、CRMP1からアクチン骨格のコントロールへと至る仕組みは不明のままだった。
フィラミンAがCRMP1と結合、アクチン骨格をコントロール
今回の研究では、まずモデル生物の線虫を用い、CRMP1と相互作用する分子を検索、アクチン結合タンパク質のフィラミン1(脊椎動物ではフィラミンA)を見出した。このフィラミン1は、UNC−33とともに働き神経回路形成に関わっていたという。
次に脊椎動物で検討したところ、フィラミンAはCRMP1との結合およびその相互作用で、Sema3A情報伝達に影響を与えていることが分かった。フィラミンAは、アクチン繊維を架橋して強い網状構造を形成することが知られている。この知見をもとに、原子間力顕微鏡でフィラミンAの分子形態を観察したところ、CRMP1が結合すると、その形が大きく変化していた。
さらにSema3A刺激に伴って、フィラミンAはCRMP1と複合体を形成し、アクチン骨格から解離していることが確認された。よって、フィラミンAによる架橋を失ったアクチン骨格が脆弱となり、ばらばらに崩壊すると推測されたとしている。
Sema3Aの作用は、アルツハイマー病の原因のひとつと考えられており、Sema3AやCRMP1は神経回路形成に関与するだけでなく、同疾病や神経損傷後の軸索再生を阻害する因子として知られている。同研究グループは今後、CRMP1とフィラミンAの相互作用部位をさらに詳しく調査し、この相互作用を抑制する新規薬剤が新たな治療薬開発へとつなげたいとしている。
▼外部リンク
・横浜市立大学 プレスリリース




