全TGF-βアイソフォーム阻害する「TβRI-TβRII-Fc」、腫瘍形成への作用は不明
東京医科歯科大学は11月17日、がんの悪性化因子であるTGF-βの全てのアイソフォームを抑制する新規Fc融合タンパク質を開発したと発表した。この研究は、同大大学院医歯学総合研究科病態生化学分野の渡部徹郎教授、井上カタジナアンナ助教、顎口腔腫瘍外科学分野の時崎詩織大学院生、東京大学、和歌山県立医科大学、理化学研究所、オールボー大学(デンマーク)らの研究グループによるもの。研究成果は、「Cancer Science」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
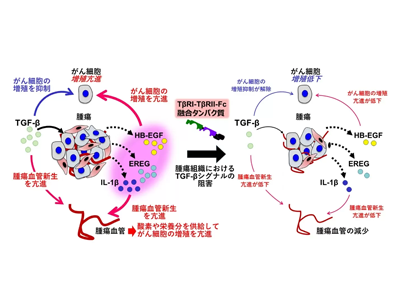
がんの悪性化はがん微小環境におけるさまざまな成長因子やサイトカインによって調節されている。こうしたサイトカインの中で、TGF-βはさまざまな種類のがんで豊富に存在し、がん細胞の上皮間葉移行(EMT)や腫瘍血管新生を誘導することで、がんの悪性化を亢進する。TGF-βにはTGF-β1、-β2、-β3という3つのアイソフォームが存在するが、その中でTGF-β2の発現はさまざまな種類のがんにおいて予後不良因子であることが知られている。TGF-βシグナルを阻害することを目的として、研究グループはTGF-β(Tβ)のI型(TβRI)ならびにII型(TβRII)受容体の細胞外領域を、免疫グロブリンのFc領域に結合させたFc融合タンパク質「TβRI-TβRII-Fc(TGF-β阻害Fc融合タンパク質)」が全てのアイソフォームを阻害することを以前報告したが、そのタンパク質の腫瘍形成に対する作用は不明だった。
TGF-β阻害Fc融合タンパク質、口腔がんマウスで副作用少なく治療効果を発揮
そこで研究グループは、ヒト口腔がん細胞を免疫不全マウスに移植した前臨床モデルを用いてTGF-β阻害Fc融合タンパク質の治療効果を検討し、TGF-βシグナル阻害ががん微小環境に与える作用を解析した。結果、TGF-β阻害Fc融合タンパク質の投与は、口腔がん細胞による腫瘍形成を阻害したが、投与したマウスの体重が減少するなどの副作用が観察されなかったことから、このTGF-β阻害剤は副作用が少ないがん治療薬であることが明らかとなった。TGF-βは上皮細胞の増殖を低下させることが報告されているが、研究グループも培養口腔がん細胞の増殖がTGF-βにより低下することを見出した。ところが、TGF-β阻害Fc融合タンパク質の投与による腫瘍組織におけるTGF-βシグナルの阻害はがん細胞の増殖を低下させていることも示されて、培養状態と腫瘍組織におけるがん細胞の増殖に対するTGF-βの作用が相反することが明らかとなった。
腫瘍組織で起こる血管新生低下、HB-EGFやKRAS低下しEMT阻害
このパラドックスを解明するために、研究グループはまず腫瘍組織における血管新生に着目した。腫瘍組織における血管は酸素や栄養分を供給することで、がん細胞の増殖を促進することが知られているが、TGF-β阻害Fc融合タンパク質の投与により腫瘍血管新生が低下していることが明らかとなった。さらに、腫瘍組織における遺伝子の発現をRNAシークエンシングの手法で解析した。その結果、TGF-β阻害Fc融合タンパク質の投与により、ヒトがん細胞ならびにマウス間質においてEMTが阻害され、細胞増殖を促進するKRASシグナルが低下していることが明らかとなった。さらに、腫瘍組織におけるTGF-βシグナルの阻害により、がん細胞の増殖や血管新生を促進する作用があるヘパリン結合性上皮細胞成長因子(HB-EGF)などの発現が低下していることが明らかとなった。
がん微小環境の、HB-EGFなど介する腫瘍形成ネットワークを遮断していた
HB-EGFはさまざまな細胞の増殖を亢進することが報告されている。そこでHB-EGFの発現を上昇させたヒト口腔がん細胞を免疫不全マウスに移植したところ、HB-EGFはがん細胞の増殖と血管新生を促進することで腫瘍形成を亢進することが明らかとなった。以上の結果から、TGF-β阻害Fc融合タンパク質ががん微小環境中のがん細胞とがん間質(血管などを含む)の間のHB-EGFなどの因子を介したネットワークを遮断することで腫瘍形成を阻害することが示唆された。
がん微小環境ネットワークを標的とした治療、神経膠芽腫など他のがん種にも応用可能
近年、がん治療の標的として、がん細胞のみならず、がん微小環境における腫瘍血管やがん悪性化を制御するがん関連線維芽細胞(CAF)やがん免疫を抑制する制御性T細胞に注目が集まっている。上皮がん細胞のEMTを誘導し、がんの転移などを亢進することでがん悪性化因子として作用するTGF-βは、腫瘍血管新生、CAFの形成、制御性T細胞の分化誘導などを介して腫瘍環境をがんの悪性化へと誘うことが明らかになり、治療の標的として注目されている。さらに、研究グループは以前、血管内皮細胞由来のCAFがTGF-β2を分泌することで、がん細胞のEMTを誘導することを報告した。つまり、がん微小環境の構成因子はネットワークを形成し、そのネットワークを制御するシグナルとしてTGF-βが重要な役割を果たすことがわかりつつある。今回がん微小環境においてTGF-βがHB-EGFなどの成長因子の発現を亢進することで、がん細胞の増殖や腫瘍血管新生を促進することが明らかとなり、がん微小環境ネットワークシグナルTGF-βの治療標的としての重要性がさらに高まりつつある。
がん微小環境中のサイトカインを阻害する分子標的治療薬の候補として、サイトカイン受容体の細胞外領域を用いたFc融合タンパク質に注目が集まっている。Fc融合タンパク質などのタンパク質製剤は血中半減期が多くの低分子医薬品よりも長いことが知られており、治療薬としての優位性があることがわかっている。「本研究の成果により、TGF-βの全てのアイソフォームを阻害できるFc融合タンパク質が、腫瘍形成をより効率良く抑制できることが示されたため、将来口腔がんのみならず、神経膠芽腫などのTGF-β2の発現が高いがん種におけるがん微小環境ネットワークシグナルを標的とした新たながん治療法への導出が期待される」と、研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース



