血液がんに対する薬効が高いサリドマイド、「催奇形性」問題を解決するには?
京都大学は8月21日、サリドマイドの重篤な副作用である催奇形性を軽減したサリドマイドの改良と、それを応用した新たなPROTAC(Proteolysis targeting chimera:タンパク質分解誘導キメラ分子)の開発に成功したことを発表した。この研究は、愛媛大学プロテオサイエンスセンターの山中聡士特定助教、澤崎達也教授、降旗大岳特定研究員、柳原裕太特定助教、今井祐記教授、名古屋工業大学大学院工学研究科の柴田哲男教授、徳島大学先端酵素学研究所の小迫英尊教授、京都大学大学院生命科学研究科の宮川拓也准教授、東京大学の田之倉優名誉教授らの研究グループによるもの。研究成果は、「Nature Communications」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
サリドマイドは1950年代に開発され、妊婦における睡眠導入剤として世界中で使用された薬剤であるが、妊婦が服用すると胎児に重篤な催奇性を引き起こしたことから、「サリドマイド薬禍」といわれる世界規模の薬害問題を引き起こした。現在、多発性骨髄腫などの血液がんに対する薬効が非常に高いことから、サリドマイド誘導体(レナリドミドおよびポマリドミド)は厳格な安全管理のもと、治療薬として年間約1兆円以上の規模で使用されている代表的な低分子薬剤となっている。
サリドマイドとその誘導体、本来の基質ではない「ネオ基質」分解し多様な薬理作用と副作用を示す
サリドマイドやサリドマイド誘導体(Immunomodulatory drugs)は、特定の「タンパク質分解をする」複合体(CRL4複合体)の基質認識を担うセレブロン(CRBN、E3ユビキチンリガーゼ)へ結合することにより、本来の基質ではない「ネオ基質」を分解し、その結果、多様な薬理作用および副作用を示すことが明らかとなっている。サリドマイドやサリドマイド誘導体は、セレブロンと標的タンパク質の間をまるで「分子糊」のように密接させることにより分解誘導することから、Molecular glue(分子糊)型のタンパク質分解誘導剤と呼ばれている。このように、サリドマイドやその誘導体はタンパク質分解というまったく新しく、そして強力な薬剤の作用機序を切りひらいた。さらに現在では、サリドマイドやその誘導体を応用し、サリドマイドやその誘導体(E3バインダー)と標的タンパク質に結合する化合物(標的バインダー)をつなぎ合わせたキメラ化合物であるPROTAC型のタンパク質分解誘導剤が開発されている。
タンパク質分解誘導剤は、これまでに治療薬の標的にすることが困難であった、酵素の様な特徴的なポケットをもたないタンパク質を標的にできることから、次世代の創薬アプローチとして世界中で大きく期待されている。しかし、サリドマイドやその誘導体やそれらを用いたPROTACは、残念なことに、サリドマイドの重篤な副作用である催奇性を引き越すネオ基質を分解することが知られており、PROTACを若い世代に利用するためには、この問題を解決する必要があった。
研究グループはこれまでに、サリドマイド催奇性に関与するネオ基質としてPLZFを発見し、サリドマイドの光学異性体における基質選択性機構を構造学的知見から明らかにし、サリドマイド催奇性の分子メカニズムを提唱している。さらに、サリドマイドやその誘導体依存的なCRBN–ネオ基質間相互作用を高感度・簡便に解析する技術を開発し、サリドマイドやその誘導体のネオ基質選択性を評価することが可能であることを報告している。これらの研究的な背景から、開発してきた技術を用いることにより、抗血液がん作用に関与するネオ基質を分解誘導し、サリドマイド催奇性に関与するネオ基質を分解誘導しない、新しく改良したサリドマイド誘導体が開発可能であると考えた。
抗血液がん作用に関与するネオ基質を選択的に分解誘導するサリドマイド誘導体を開発
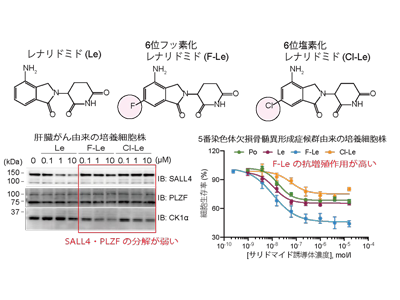
はじめに、サリドマイドやサリドマイド誘導体のネオ基質選択性に重要であるフタルミド環をさまざまな置換基にて修飾したサリドマイド誘導体を有機合成した。有機合成したサリドマイド誘導体のネオ基質選択性を詳細に解析した結果、レナリドミドの6位をフッ素や塩素などの比較的小さな原子で置換したレナリドミド誘導体は、抗血液がん作用に関与するネオ基質(IKZF1やIKZF3、CK1α)を分解誘導する一方で、催奇性に関与するネオ基質(SALL4やPLZF)の分解誘導は弱いことが明らかとなった。
多発性骨髄腫や5qMDS症候群に既存薬と同等以上の抗増殖作用
さらに、6位フッ素化レナリドミド(F-Le)は、サリドマイドやその誘導体が治療薬として用いられている血液がんである多発性骨髄腫や5番染色体欠損骨髄異形成症候群由来の培養細胞に対して、既存薬レナリドミドと同等以上の抗増殖作用を示した。
6位をより大きな置換基で修飾、催奇性・抗血液がん作用関与どちらも非分解
CRBNはさまざまな組織・細胞に発現しタンパク質の分解活性が高く、サリドマイドやその誘導体は分子量が小さいE3バインダーであるため、さまざまな疾患に対するPROTACへと利用されている。しかしながら、血液がん以外の疾患を対象にする場合、血液細胞の分化制御するネオ基質(IKZF1やIKZF3、CK1α)の分解は副作用を惹起する可能性がある。
そこで、レナリドミドの6位をより嵩高い置換基で置換したサリドマイド誘導体を有機合成した。その結果、レナリドミドの6位をトリフルオロメチル基(F3C-基)のような大きな置換基で修飾したレナリドミドは、催奇性に関与するネオ基質(SALL4やPLZF)だけでなく、抗血液がん作用関与ネオ基質(IKZF1やIKZF3、CK1α)の分解も引き起こさないことが明らかになった。
6位修飾レナリドミド+BETタンパク質阻害剤のPROTACs、大腸がん細胞などで顕著な抗増殖作用
次に、6位修飾レナリドミドとさまざまながん種において治療標的とされているBETタンパク質(BRD2、BRD3、BRD4)に対する阻害剤OTX-015を用いたPROTACsを有機合成した。重要なことに、6位修飾レナリドミドを用いたPROTACsはBETタンパク質を分解誘導し、6位修飾レナリドミドと同様のネオ基質選択性を示した。さらに、6位修飾レナリドミドを用いたPROTACは神経芽細胞腫や大腸がん由来の培養細胞株に対して顕著な抗増殖作用を示した。つまり、PROTACとして機能できるが、既知のネオ基質を分解しない改良サリドマイド誘導体の開発に成功したことを意味する。これらの結果は、6位修飾レナリドミドが催奇性を回避した血液がんに有効なサリドマイド誘導体であり、さらにこれらの化合物が疾患標的タンパク質を選択的に分解できるPROTAC開発に利用できることを示している。
ネオ基質選択性を制御可能なレナリドミド誘導体を用いた新規製剤開発に期待
タンパク質分解誘導剤は、細胞内からネオ基質や標的タンパク質を徹底的に取り除く。その効果は絶大で、多発性骨髄腫への高い治療効果を示す一方で、胎児の催奇性を引き越すほど重篤な副作用も引き起こした。したがって、標的となるタンパク質のみを正確に分解するタンパク質レナリドミドとその誘導体を用いたPROTACの化学構造とネオ選択性の分解誘導剤の開発は極めて重要である。
今回の研究において開発されたレナリドミド誘導体は、抗血液がん作用に関与するネオ基質を特異的に分解し、既存薬として最も広く用いられているレナリドミドと比較して、同等以上の抗増殖作用を示した。今後、生体内における抗腫瘍効果および催奇性誘発能の評価を行い、サリドマイド催奇性を回避した血液がんに有効なサリドマイド誘導体が開発されることが期待される。
現在、より強力な抗血液がん作用をもつ新規なサリドマイド誘導体の開発が行われており、すでに臨床段階にある。したがって、研究において得られた知見を活用することで、より有効性の高い安全な新規サリドマイド誘導体の開発につながることが期待される。さらに、さまざまな研究から、サリドマイドやその誘導体を用いたPROTACは非常に有効性が高いことが証明されており、すでにいくつかのPROTACは臨床段階にある。「研究で見出したネオ基質選択性を制御可能なレナリドミド誘導体を用いることで、副作用を軽減したPROTACの開発につながることが大きく期待される」と、研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る



