狙った病原細胞に低濃度の薬剤を選択的に導入する技術開発が望まれている
大阪公立大学は12月16日、がんの治療に有用な生物機能性分子を細胞内に導入する際の光誘導加速に関する新技術の基礎構築に成功したと発表した。この研究は、同大研究推進機構協創研究センターLAC-SYS研究所の中瀬生彦所長補佐、飯田琢也所長、床波志保副所長らの研究グループによるもの。研究成果は、「Nano Letters」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
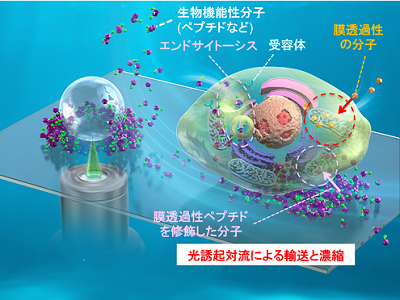
細胞膜は細胞の恒常性を維持するためのバリアであり、ペプチド、タンパク質、核酸などの生物学的機能分子を細胞内に送り届ける役割を担う。特定の細胞内小器官に生物機能性分子を到達させて細胞機能を操作するためには細胞膜透過が必要不可欠だ。たとえば、がん細胞を細胞死の一種であるアポトーシスなどで死滅させるためにも、細胞膜透過の効率を向上させる必要がある。従来の細胞内取り込みのプロセスには、エンドサイトーシスなどさまざまなプロセスがあるが、いずれも数μmol/L~数十μmol/Lと高濃度の生物機能性分子が必要であり、また低い細胞膜透過性のために、狙った細胞内小器官に生物機能性分子を到達させられる確率が低く、薬物活性が低いことが問題視されている。現在、細胞膜透過性を高め、細胞内へ高効率に送達可能な運搬体をつくる研究開発が盛んに行われているが、細胞膜を通過し細胞内へ効果的に機能分子を送り届けるためには、数十μmol/L程度のペプチド濃度が必要とされている。
加えて、細胞選択性が乏しいことで、がん細胞だけでなく正常な細胞へのダメージも避けられず、狙った細胞のみへの投与を高効率に行う技術構築が必要であり、副作用を避けるために低濃度の薬剤を狙った病原細胞に選択的に導入する技術の開発が切望されている。選択的な細胞機能制御による薬効評価の高効率化が実現できれば、個々の細胞と薬剤の相性を調べる手法開発を加速することができ、創薬・医療分野の発展も期待される。
100秒のレーザー照射による光発熱効果で発生した対流を駆使し、生細胞付近に分子を濃縮
研究グループは今回、超放射の補助による光誘起対流を用いて、細胞透過性ペプチド(CPP)を含む生体機能性分子の細胞膜への集積と透過性向上を実現し、1,000分の1程度のnmol/Lレベルでの光誘起集合のドラッグデリバリーシステムへの応用を実証した。
具体的には、細胞培養液中の生細胞の周りに光発熱集合を誘起するために、プラズモニック超放射を示す高密度に金ナノ粒子を固定したガラスボトムディッシュ、または金薄膜をコーティングしたガラスボトムディッシュに、生体にほとんど吸収されずダメージを与えない波長1,064nmの赤外レーザー(出力:100mW~400mW)を10倍対物レンズで100秒間集光し、基板上の細胞から100μmほど離れた位置にある目的の生細胞付近に分子を濃縮した。
従来の1,000分の1の濃度でミトコンドリアだけを選択的に染色することに成功
研究グループは、細胞内小器官であるミトコンドリアだけを染色するMitoTrackerという低分子を用いた実験も行った。従来の自然の細胞内導入では500nmol/L以上必要だが、レーザー照射点から離れた場所での比較実験結果では、100分の1に相当する5nmol/Lや1,000分の1に相当する500pmol/Lのように低濃度ではほとんど細胞内に入らずミトコンドリアを染色できていなかった。一方、レーザー照射点付近の実験結果では、わずか1,000分の1の濃度である500pmol/Lでも光誘起バブル近傍の細胞内のミトコンドリアだけを選択的に染色できた。
従来の100分の1の濃度の抗がん活性ペプチドでがん細胞にアポトーシスを誘導
さらに、光誘導加速により従来法よりも100分の1の濃度に相当する50nmol/Lの抗がん活性ペプチド(R8-PAD)を用いてアポトーシスへの誘導に成功し、非常に効率的で選択的な細胞内への取り込みと狙ったがん細胞の破壊に成功した。
薬剤開発の低コスト化や創薬プロセスの加速にも寄与する研究成果、特許査定中
細胞への取り込み、細胞膜への浸透、細胞質輸送を極低濃度の標的分子により効率的に行える革新的な技術を提供する今回の研究成果は、細胞への薬効評価の高効率化や副作用の低減などに関する新たな知見を与えるものと考えられる。また、高価な新薬の細胞試験における薬剤量を大幅に削減して低コスト化や創薬プロセスの加速にもつながることが期待される。「選択的な細胞機能制御や薬効評価、個々の細胞と薬剤の相性をハイスループット(自動的かつ高速に細胞への薬剤活性などを評価)に調べる手法の提供やプレシジョン・メディスン(精密医療)やテーラーメード医療など創薬・医療分野へのブレークスルーを与え得るものだ。現在、研究成果の基礎部分の発明も特許査定を受けており、製薬メーカーなどとの産学連係での研究開発も進めていく」と、研究グループは述べている。
▼関連リンク
・大阪公立大学 プレスリリース



