微弱パルス電流(MES)と温熱(HS)の併用処置、NSに対する有効性は?
熊本大学は10月30日、生物活性を指標に最適化した微弱パルス電流(MES)と温熱(HS)の併用処置(MES+HS)が、腎臓において抗炎症作用や抗線維化作用を発揮するとともに、腎臓細胞のアポトーシス(細胞死)を抑制することでネフローゼ症候群(NS)に対し保護的に働くことを発見したと発表した。この研究は、同大大学院生命科学研究部(薬学系)遺伝子機能応用学研究室の寺本啓祐大学院生、甲斐広文教授らの研究グループによるもの。研究成果は、「Scientific Reports」に掲載されている。
画像はリリースより
NSは、腎臓の尿濾過機能を担う糸球体の障害が生じた結果、大量の血中タンパク質が尿中へと漏出し、低アルブミン血症や浮腫などを併発する腎疾患の総称。NSの治療には、ステロイドが第1選択薬として用いられており、一定の効果を示している。しかしながら、ステロイドにより病態が寛解した後、再発を繰り返す頻回再発型NSや、ステロイドに対し治療抵抗性を示すステロイド抵抗性NSが存在する。これらは難治性NSと呼ばれ、治療応答性の低さや予後の悪さが問題になっている。また、NSは、その性質上、長期にわたる疾患コントロールを要することが多く、既存薬の長期間服用による副作用の出現も危惧されている。このような背景から、有効かつ安全な新規治療法の開発が望まれている。
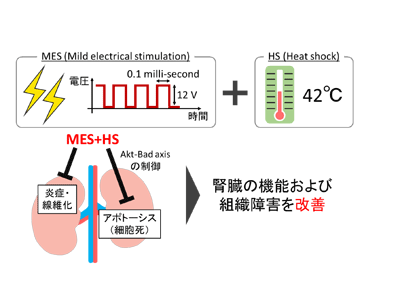
電気や温熱などの物理刺激は古来より医療目的に用いられており、経験的に病態改善効果を有することが知られている。甲斐教授らは、生物活性に着目し最適化した微弱パルス電流(Mild electrical stimulation: MES)と、電流作用の増強を目的とした温熱(Heat shock: HS)との併用に着目し、MES+HSの有用性を検討してきた。その中で、MES+HSが2型糖尿病や乾癬を始めとするさまざまな疾患において病態改善効果を発揮することが明らかになった。さらに、2型糖尿病に関してはヒト患者を対象とした臨床研究も行われており、副作用なく糖代謝パラメーターの異常を是正することが示されている。これらの知見から、MES+HSは多様な作用標的を有する安全性の高い処置として、さまざまな疾患の新規治療法となることが期待されています。これらの基礎的知見をもとに、今回の研究では、新規治療法の開発が望まれるNSに対するMES+HSの有効性について、検討が行われた。
MES+HS処置で難治性NSモデルマウスの腎機能を改善
研究には、難治性NSを模擬することで知られる、アドリアマイシン(ADR)誘導性NSモデルマウスを用いた。ADR投与の前日から、MES+HS([MES条件:パルス幅0.1ミリ秒、55pps、12V]、[HS条件:42℃])を1回10分、週に2回の頻度で処置し、病態の変化を4週間経時的に観察した。まず、腎機能に関して検討を行ったところ、病態モデルマウスの尿中に漏出するアルブミン量が病態誘導後7日目から増加し10日目にピークを迎えた一方、MES+HS処置群では、尿中アルブミン量が7日目には50%、10日目には75%減少した。また、タンパク尿スコアについても、MES+HSは経時的に抑制効果を発揮した。さらに、MES+HS処置群は病態誘導によって増加する血清中のクレアチニン値を36%、血中尿素窒素(BUN)値を24%減少させた。これらの結果から、MES+HSがADRによって低下する腎機能を改善することが明らかとなった。
ポドサイト減少や硬化病変を改善、炎症や線維化も抑制
次に、腎組織学的な障害について検討を行った。ADR投与により病態モデルでは腎臓の尿濾過機能を担う糸球体の硬化病変が認められたが、MES+HS処置群ではADRによる硬化病変が抑制され、特に、重度の硬化病変(糸球体面積の75%以上が硬化領域)を呈する糸球体の割合については59%の抑制効果を示した。また、病態に伴い尿細管障害を反映するタンパク円柱領域の増大が確認されたが、MES+HS処置群ではタンパク円柱領域の減少が見られ、MES+HSが糸球体のみならず尿細管に対しても保護作用を発揮することが示唆された。さらに、FSGSの起点となる糸球体上皮細胞(ポドサイト)数の減少について、免疫染色により評価したところ、病態時に認められるポドサイト数の減少がMES+HSによって改善した。これらの結果から、MES+HSがADR投与による腎組織障害を抑制すること、ポドサイト数の減少を制御する何らかのメカニズムが存在することが示唆された。
続いて、ポドサイト数の減少を抑制するメカニズムを探索するため、MES+HSが腎組織の細胞死に与える影響を検討した。腎組織内のアポトーシス細胞をTUNEL染色により評価したところ、ADRによって増加するアポトーシス細胞数はMES+HSにより減少した。この結果と一致するように、アポトーシスの実行因子である活性化Caspase3(CC3)のタンパク質発現量の増加もMES+HSによって抑制されたことから、MES+HSが抗アポトーシス作用を有することが示された。さらに、そのメカニズムとして細胞内の生存シグナル分子として知られるAktに着目したところ、MES+HSによりAktがリン酸化され活性化するとともに、その下流のアポトーシス促進因子Badが不活性化されることが見出された。この結果は、細胞を用いたin vitro実験系においても確認され、Aktのリン酸化阻害剤LY294002による処置でMES+HSの抗アポトーシス作用が消失することから、MES+HSの作用にAkt-Bad経路が関わることが明らかとなった。
上記の結果に加え、NSの進行に関わる炎症や線維化について遺伝子発現量解析を行ったところ、MES+HSが炎症性サイトカイン(Il1-beta、Il6等)や線維化因子(Tgf-beta、Col1a1等)の発現量を減少させることが見出された。これは、MES+HSが炎症や線維化に対し抑制的に作用し得ることを示唆している。以上の検討から、微弱な電気刺激と温熱刺激を組み合わせたMES+HSが、AktBad経路を制御し抗アポトーシス作用を発揮するとともに、炎症や線維化を抑制することでADR誘導性NSの腎病態を改善することが明らかになった。
MES+HSは、他の臨床試験から、ヒトに対して安全性の高い医療機器となりうることが明らかとなっている。研究グループは、「今回の研究成果により、今後、NSに関わる複数因子を同時に標的化する刺激として、臨床応用することが期待される」と、述べている。
▼関連リンク
・熊本大学 お知らせ



