経口アンドロゲン受容体阻害剤「エンザルタミド」、第3相臨床試験の患者組み入れを開始
12月4日、アステラス製薬株式会社は、経口アンドロゲン受容体阻害剤「エンザルタミド」について、非転移性去勢抵抗性前立腺がん患者を対象とした第3相臨床試験(PROSPER試験)の患者組み入れを開始したことを発表した。エンザルタミドは、アステラス製薬が米国メディべーション社と共同で開発・商業化を進めており、今回の臨床試験については、米国においても12月3日に対外発表している。
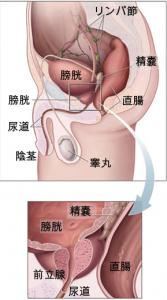
(画像はWikiメディアより引用)
非転移性去勢抵抗性前立腺がん患者約1500名を対象に
プラセボ対照および二重盲検試験として行う今回の臨床試験には、米国・カナダ・欧州・南米・アジア太平洋地域の医療機関において、非転移性去勢抵抗性前立腺がん患者約1,500名が組み入れられる予定だ。アンドロゲン除去療法後に増悪したリスクの高い前立腺がん患者のうち、無症候性かつ今までに転移が確認されていない患者を対象とする。
主要評価項目は無転移生存期間で、一方の群には標準療法に加えてエンザルタミド(160mgを1日1回投与)を投与し、他方の群には標準療法にプラセドを投与して比較する。今回の第3相臨床試験により、前立腺がん患者に対する新たな治療選択肢の提供が期待される。(鈴木ミホ)
▼外部リンク
アステラス製薬株式会社 プレスリリース
http://www.astellas.com/jp/




