進行性の神経変性を引き起こすライソゾーム病GM1、酵素補充療法は効果期待できず
順天堂大学は6月2日、血液脳関門通過型の治療タンパク質を用いた遺伝性疾患のGM1ガングリオシドーシス(GM1)モデルマウスに対するアデノ随伴ウイルス(AAV)ベクターによる遺伝子治療法を確立したと発表した。この研究は、同大大学院医学研究科脳回路形態学の日置寛之教授、東京慈恵会医科大学遺伝子治療研究部の松島小貴助教、小林博司教授、医学部看護学科の大橋十也教授、臨床医学研究所の渡部文子教授、JCRファーマ株式会社の薗田啓之氏らの研究グループによるもの。研究成果は、「The Journal of Clinical Investigation」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
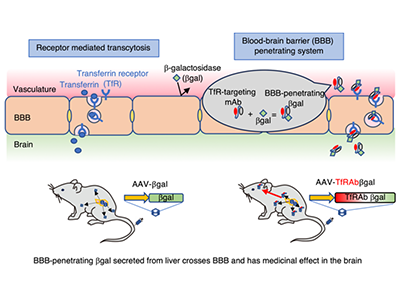
GM1はライソゾーム病(LSD)の一種。ライソゾーム酵素であるβガラクトシダーゼ(βgal)をコードするGLB1遺伝子の遺伝子変異で発症する、遺伝性疾患である。βgalの欠損により基質であるGM1ガングリオシドが中枢および末梢神経系の細胞、特に神経細胞に異常に蓄積した結果、進行性の神経変性を引き起こす。現在、有効な治療法はない。ムコ多糖症Ⅱ型など一部のLSDでは、欠損した酵素を毎週の点滴で補う酵素補充療法が行われているが、酵素タンパク質は脳のバリア機能である血液脳関門を通過できないため、中枢神経症状には効果が期待できなかった。
酵素タンパク質が血液脳関門を通過できる技術+遺伝子治療、GM1モデルマウスで検証
近年JCRファーマ社は、ある抗体を融合することで酵素タンパク質が血液脳関門を通過できる技術、J-Brain Cargo(R)を開発した。この技術によりムコ多糖症Ⅱ型の中枢神経症状を酵素補充療法により改善することが期待されている。しかしβgalタンパク質の構造が不安定であるためGM1に対する酵素補充療法は存在しない。そこで今回の研究では、βgalのJ-Brain Cargoを体内で安定的に発現するシステムとして、その発現遺伝子をAAVベクターに搭載し、GM1モデルマウスを用いて遺伝子治療を行った。
J-Brain Cargo技術を応用した抗体融合酵素発現遺伝子を搭載したAAV(Tβgal)を10週齢のGM1モデルマウスへ静脈投与し、半年後の脳の酵素活性および蓄積物質の測定による生化学的解析、免疫染色による病理学的解析、複数の行動学的解析を行った。
遺伝子治療マウス、未治療群と比べ有意な改善
その結果、Tβgal治療群は生化学的および病理学的解析においてほぼ正常化しており、行動学的解析でも未治療群と比べ有意な改善が認められた。
他のライソゾーム病や神経変性疾患への応用に期待
研究グループは、研究の臨床応用に向けた検討を進めているとしている。また、同システムは他のライソゾーム病や神経変性疾患への応用が期待できると考えている、と述べている。
▼関連リンク
・順天堂大学 プレスリリース



