細菌療法を含むがん免疫療法は「免疫細胞の力」が不可欠とされてきた
北陸先端科学技術大学院大学は8月6日、2種の細菌による新たながん治療へのアプローチ「AUN(阿吽)」を開発したと発表した。この研究は、同大物質化学フロンティア研究領域の都英次郎教授の研究グループと、第一三共株式会社ならびに筑波大学生命環境系の高谷直樹教授らとの共同研究によるもの。研究成果は、「Nature Biomedical Engineering」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
がん免疫療法は、1868年にドイツの医師Buschが細菌感染を意図的に引き起こしたがん患者の治癒例を報告したことに端を発し、1893年にはWilliam Coley博士が「細菌を用いたがん治療法」を提唱して以来、150年以上にわたり発展を続けている。Coley博士は「がん免疫療法の父」と称され、彼の遺志は現代の免疫チェックポイント阻害剤やCAR-T細胞治療へと受け継がれている。
しかしこれまで、細菌療法を含むがん免疫療法は「免疫細胞の力」が不可欠とされてきた。また、化学療法や放射線治療などの標準治療を受けたがん患者の多くが免疫不全状態にあり、このような状況では免疫細胞の力が抑えられるため、効果が著しく制限されてきた。
2種の天然細菌が阿吽の呼吸で共存、担がんモデルマウスに明確な腫瘍抑制効果を発揮
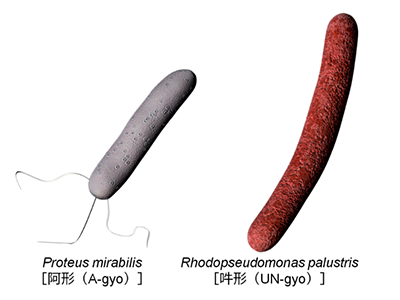
今回の研究では、T細胞やB細胞などの主要な免疫細胞に頼ることなくがんを攻撃する、世界でも類を見ない新しい治療へのアプローチを明らかにした。使用するのはAUN(阿吽)と名付けられた2種の天然細菌(腫瘍内に常在するProteus mirabilis[阿形(A-gyo)]と、光合成を行うRhodopseudomonas palustris[吽形(UN-gyo)])である。この2種が阿吽の呼吸で共存することで、各種ヒトがん細胞を皮下移植した担がんモデルマウスに対して明確な腫瘍抑制効果を発揮した。
UN-gyoはA-gyoとの共存・混在で、がん細胞への毒性を高める「制御役」となる可能性
そのメカニズムは極めてユニークで、まさに阿吽の呼吸のように2つの細菌が協調し、一連の現象を連携して引き起こす。そのメカニズムの一例を挙げると「腫瘍血管とがん細胞の選択的破壊」「がん代謝物によるA-gyoの構造変化(線維状化)による抗腫瘍強化」「細菌間の構成比率の変化による機能最適化(ポピュレーションシフト)」「病原性の抑制と副作用の回避(サイトカインストームの軽減)」などがある。
さらにUN-gyoはA-gyoと共存・混在することにより、両者の病原性を抑制しながら、がん細胞に対する特異的な毒性を高める「制御役」として機能する可能性がある。この2種の細菌が示す絶妙なバランスと相互作用こそが、腫瘍抑制効果の鍵となっている可能性がある。
免疫不全状態にあるがん患者への新たな選択肢となることを目指す
この治療へのアプローチは、免疫不全状態にあるがん患者への新たな選択肢となる可能性があり、今後のさらなる研究と検証が期待される。実際に、同研究では免疫細胞が機能しにくいマウスモデルやヒトがんモデルにおいても、細菌が自律的にがん細胞および腫瘍血管を標的として作用する様子が確認された。このようなT細胞やB細胞などの「免疫細胞」に依存しない方法は、従来のがん免疫療法とは異なるアプローチとして注目されている。
「本成果の社会実装を見据え、がん細菌療法の実用化に向けたスタートアップの創業準備も進行中だ。150年以上前から構想されてきたがん細菌療法の概念に新たな技術的進展を加えることで、その応用可能性を慎重かつ段階的に検討していく段階に入っている」と、研究グループは述べている。
▼関連リンク
・北陸先端科学技術大学院大学 プレスリリース



