KP-100IT脊髄腔内投与時の安全性と有効性の確認を目的に
クリングルファーマ株式会社は6月19日、脊髄損傷急性期患者に対し、同社が開発中の組換えヒト肝細胞増殖因子(HGF)製剤(KP-100IT)を脊髄腔内投与したときの安全性および有効性を確認する第1/2相臨床試験(多施設共同プラセボ対照二重盲検比較試験)の結果を発表した。同試験は、慶應義塾大学医学部生理学教室の岡野栄之教授、整形外科学教室の中村雅也教授らの研究成果を基に、中村雅也教授を治験調整医師として実施した。臨床試験の結果は、「Journal of Neurotrauma」誌に掲載されている。
画像はリリースより
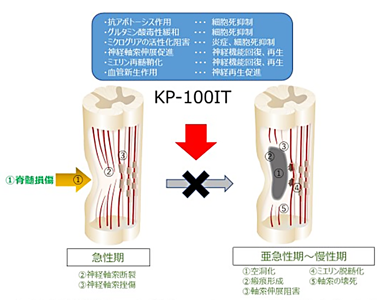
脊髄損傷は、交通事故や転倒などによって脊髄実質が損傷し、末梢の運動・感覚・自律神経系のまひをきたす難治性疾患。国内の脊髄損傷患者の発生者数は5,000人/年と推定されており、近年は、交通事故やスポーツによる受傷者が減少する一方で、高齢化社会の進展に伴い高齢者の受傷が増加傾向にある。病態では、最初の脊髄損傷受傷に続いて、急性期に炎症反応等によって損傷した部分が拡大する現象(二次損傷)が起こり、慢性期には脱落した神経細胞が空洞化し回復しにくくなる。このため、脊髄損傷治療では、二次損傷を抑制してできるだけ多くの脊髄を残存させることが最も重要だ。二次損傷抑制は大きな運動機能回復につながり、患者や家族のQOLの向上に貢献すると期待される。現在、脊髄損傷急性期に使用できる有効かつ安全な治療薬はない。
頚髄損傷で運動完全麻痺の重度の患者を対象に45例を登録
HGFは、成熟肝細胞のDNA合成を促進する生体内物質として日本で発見され、その後の研究によって、肝臓以外の多くの組織・臓器に対しても広く生物活性を示すことが明らかになった。神経細胞および支持細胞に対しても作用する神経栄養因子としても多くの報告があり、様々な神経変性疾患の治療薬となることが期待されている。HGFは、脊髄損傷において、急性期の二次損傷による神経細胞死を抑制し、神経や血管の再生を促す多面的な治療効果が期待されており、これまで、ラットやマーモセットを用いた脊髄損傷動物モデルにおいて治療効果が報告されている。
同社では、組換えヒトHGFタンパク質(KP-100)の開発を進めており、中枢神経疾患に対する治療薬として脊髄腔内投与製剤(KP-100IT)を開発した。
今回の試験は、3つの脊髄損傷専門病院(労働者健康安全機構総合せき損センター、労働者健康安全機構北海道せき損センター、国立病院機構村山医療センター)の協力を得て実施した。脊髄損傷では損傷の程度によって回復が異なるといわれている。そこで、KP-100ITの効果が検出されやすくすることを目的として、同試験の対象患者は自然回復の少ない頚髄損傷で運動完全まひ(改良Frankel分類A/B1/B2)の重度の患者を対象とした。また、受傷直後の脊髄ショックから離脱する3日後を待って厳密に重症度評価を実施。投与はKP-100ITまたはプラセボを受傷後3日後から開始し、週1回間隔で合計5回反復投与を行い、入院しながらリハビリテーションを継続し6か月間観察した。試験の期間は2014年6月~2018年5月までで、45例が登録された(実薬群28例、プラセボ群17例)。
最終観察時の下肢運動機能獲得は、プラセボ群6.3%、KP100IT群33.3%
試験の結果、KP-100IT投与により、主要評価項目のASIA motor scoreの受傷後Day168時点の変化量ではプラセボ群に対して有意差なかった。しかし、経時的な推移では両側P<0.100で差が一貫しており、Day140時点では有意差が得られた。また、上肢/下肢別運動機能の評価では、下肢運動機能のDay140時点およびDay168時点で有意差が認められた。重度の頚髄損傷完全まひ患者では、最終観察時において下肢運動機能を獲得した症例はプラセボ群において6.3%(1/16例)であった一方、KP100IT群では、33.3%(5/15例)の患者が終了時に下肢運動機能を獲得したという(p=0.083)。
安全性については、軽度の副作用のみで治験薬と因果関係のある重篤な有害事象はなく、KP-100ITに対する抗体が検出されなかったことから、安全性に大きな問題はないと考えられるとしている。
以上の結果より、脊髄損傷急性期患者の対するKP-100ITの投与について、安全性に大きな問題はなく、機能回復効果を有する可能性があることが明らかとなった。
P3試験の計画進行中、国内での早期の薬事承認取得を目指す
KP-100ITによる脊髄損傷治療は、安全性に加えて、受傷後に直ちに投与できる製剤の利便性からも急性期治療に適した薬剤といえるという。また、二次損傷を早期に抑制する効果によって、将来的には亜急性期~慢性期治療として期待されるiPS細胞由来神経幹細胞等の細胞治療の効果を高めることも期待される。
同試験の結果を受け、KP-100ITは2019年9月に厚生労働省より希少疾病用医薬品指定を受けた。現在、第3相臨床試験の計画が進められており、国内での早期の薬事承認取得を目指すとしている。
▼関連リンク
・クリングルファーマ株式会社 お知らせ



