MACs摂取と絶食を組み合わせ、短時間で腸内細菌叢を再構築する新たな手法を提案
北里大学は7月9日、絶食中に腸内細菌が代謝可能な糖質(腸内細菌利用糖:Microbiota-Accessible Carbohydrates:MACs)を摂取することで、腸内細菌叢を短時間で選択的に再構築する新たな食事介入法を開発したと発表した。この研究は、慶應義塾大学先端生命科学研究所/同大大学院政策・メディア研究科博士課程(研究当時)の佐藤謙介氏、同大先端生命科学研究所の福田真嗣特任教授、同大薬学部生化学講座・北里大学薬学部微生物学教室の井上浄訪問(客員)教授、北里大学薬学部微生物学教室の金倫基教授(研究当時:慶應義塾大学薬学部創薬研究センター教授)を中心とする研究グループによるもの。研究成果は、「BMC Microbiology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
腸内細菌叢は100兆個以上の細菌細胞から構成される複雑な生態系であり、「superorganism(超生命体)」とも称される。近年、腸内細菌由来の代謝物質が認知機能や免疫、炎症制御など、宿主の多様な生理機能の維持に重要な役割を果たしていることが明らかになっている。腸内細菌は、食事に含まれる成分、特に腸内細菌利用糖(MACs)を栄養源として増殖するため、これらを利用して腸内細菌叢を望ましい方向へ変化させる「食事介入」が注目されている。しかし、腸内には多種多様な細菌が共存し、互いに競合あるいは相互摂食しながらバランスを保っており、このような外的要因に対する頑健性(resilience)が、介入による腸内細菌叢の変化を妨げる大きな要因となっている。一方、先行研究では、絶食によってこの頑健性が一時的に低下し、腸内細菌叢の構成が大きく変化すること、さらにはその変化が一定期間維持され得ることも報告されている。
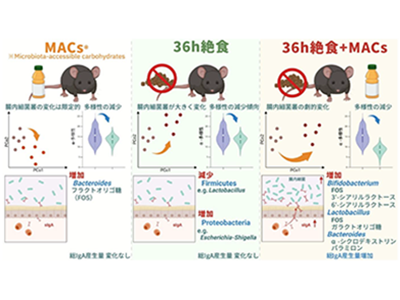
そこで研究グループは今回、腸内細菌の選択的増殖を誘導するMACsの摂取と、腸内細菌叢の構造を変化させる絶食を組み合わせることで、短時間で腸内細菌叢を効率的に再構築する新たな手法を提案した。
絶食でマウス腸内細菌叢が顕著に変化、腸内細菌叢を短時間で再構築可能な手段と判明
これまでの研究により、絶食が腸内細菌の動態に影響を与え、宿主の生理機能を変化させる可能性が指摘されている。特に、絶食は腸内細菌叢の頑健性(robustness)を一時的に低下させることで、外的な刺激に対する感受性を高めると考えられている。しかし、既存の研究は断続的絶食や長期絶食など多様な条件下で実施されており、マウスの系統や疾患モデルの違いによって結果が異なることから、絶食が腸内細菌叢に及ぼす影響については未解明な点が多く残されていた。
そこで、絶食が腸内細菌叢の構成に与える影響を明確にするため、C57BL/6Jマウスに対して36時間の完全絶食(水のみ)を行い、腸内細菌叢の構成変化を解析した。その結果、絶食により腸内細菌叢は短時間で顕著に変化することが明らかとなった。具体的には、Bacteroidota門やPseudomonadota門に属する細菌の相対存在量が増加し、Bacillota門、特にLactobacillus属に属する細菌の相対存在量が有意に減少した。これにより、絶食が腸内細菌叢の構成を短時間で再構築可能な手段であることが実証された。
Lactobacillus属の相対存在量が絶食+FOS群で有意に増加
先行研究や今回の研究結果から、Lactobacillus属細菌は消化管内の栄養状態に応答しやすく、フラクトオリゴ糖(FOS:Fructooligosaccharides)などの特定の糖質を資化して増殖する能力をもつことが知られていた。
そこで、絶食中にFOSを投与することで、Lactobacillusの選択的増殖が可能か否かを検証した。マウスに36時間の絶食を施し、その期間中にFOSを経口投与したところ、絶食+FOS群では腸内細菌叢の多様性が低下し、絶食単独群とも異なるユニークな腸内細菌叢組成を示すことが明らかとなった。さらに詳細な解析の結果、Lactobacillus属の相対存在量が絶食+FOS群において有意に増加していることが確認された。
加えて、腸内細菌叢の制御や感染防御に重要なIgA抗体の産生が、絶食+FOSの条件下で有意に増強されることも明らかとなり、免疫機能の活性化に資する可能性が示唆された。
Bifidobacteriumの選択的増殖に最も効果的なのは、36h絶食中に12hごとにMACs摂取
次に、同手法の効果をさらに高めるため、絶食とMACs摂取の最適な組み合わせ条件を検討した。36時間の絶食期間中における投与量やタイミングの違いが、健康維持との関連が示されているBifidobacterium属細菌の増殖に与える影響を評価した。
その結果、絶食開始から12時間ごとに3回MACsを投与する「パターンC」が、他の投与法と比較して最も高いBifidobacteriumの相対存在量を示すことが明らかとなった。さらに、絶食の持続時間と菌の増殖との関係を検討したところ、36時間の絶食がBifidobacteriumの増殖に最も有効であることが確認された。
これらの結果から、36時間の絶食中に12時間ごとにMACsを摂取する投与パターンが、Bifidobacteriumの選択的増殖に最も効果的であることが示された。
新規手法が腸内細菌叢の構成変化と粘膜免疫応答の調節の両面で有用な可能性
同手法が他の難消化性オリゴ糖においてもBifidobacteriumの増殖促進効果を示すか否かを検証するため、ヒトミルクオリゴ糖の一種である「6′-シアリルラクトース(6SL:6′-sialyllactose)」を用いて解析を行った。その結果、絶食中に6SLを投与したマウスでは、Bifidobacteriumに加え、Parabacteroides、Atopobiaceae、Burkholderiaceaeといった複数の腸内細菌の相対存在量が有意に増加することが確認された。さらに、糞便中のTotal IgA産生量も有意に増加しており、同手法が腸内細菌叢の構成変化と粘膜免疫応答の調節の両面において有用である可能性が示唆された。
短期介入でも多糖類の腸内細菌叢および粘膜免疫への影響を効率的に高めることが可能
最後に、オリゴ糖とは構造の異なる糖類による腸内細菌叢への作用を検証するため、酵母・穀類・菌類などに含まれる多糖類β-グルカンの一種である、微細藻類ユーグレナ由来のパラミロンに着目した。従来の研究では、パラミロンによる腸内細菌叢への影響を得るには約30日間の継続摂取が必要とされていたが、同研究では絶食中にパラミロンを投与することで、36時間という短時間でBacteroidesや[Eubacterium] coprostanoligenesの相対存在量が有意に増加することを確認した。さらに、糞便中のTotal IgA産生量も有意に増加しており、短期介入であっても多糖類の腸内細菌叢および粘膜免疫への影響を効率的に高められる可能性が示された。
絶食+MACsの介入法、ヒトへの応用にはさらなる研究と臨床的検証が必要
今回の研究により、絶食が腸内細菌叢の構造に顕著な変化をもたらすこと、さらに絶食中に腸内細菌利用糖(MACs)を投与することで、短期間に特定の腸内細菌の選択的増殖とIgA抗体の産生を誘導できることが明らかにされた。今後は、これらの変化が再摂食後にもどの程度持続し、宿主の生理機能にどのような影響を及ぼすか、また、その分子メカニズムについての詳細な解明が求められる。
絶食とMACsの併用による腸内細菌叢の精密な制御は、今後さまざまな食品成分・薬剤・治療法と組み合わせることで、個人の腸内環境や病態に応じた介入効果の最適化に貢献できる可能性がある。また、抗生物質や過剰な薬剤投与を伴うことなく、腸内環境や粘膜免疫に作用し得る点も同手法の大きな利点といえる。
「これらの成果は、絶食とMACsを組み合わせた介入法が、腸内細菌叢の構造的リモデリングを目的とした新たな栄養学的アプローチとして、疾患予防や治療における応用可能性を有することを示唆している。ただし、本研究は動物モデルに基づくものであり、ヒトへの応用にはさらなる研究と臨床的検証を通じた安全性・有効性の確認が不可欠だ」と、研究グループは述べている。
▼関連リンク
・北里大学 新着情報



