有効な分子標的薬の少ないTNBC、がん細胞の浸潤に関連する機構は?
東京薬科大学は2月15日、トリプルネガティブ乳がん(TNBC)においてMAP1B(Microtubule-Associated Protein 1B)とよばれるタンパク質ががん細胞の転移・浸潤を促進していることを発見したと発表した。この研究は、同大生命科学部分子細胞生物学研究室の井上弘樹講師、国立がん研究センター中央病院病理診断科の吉田正行医員、新潟大学大学院医歯学総合研究科薬理学分野の吉松康裕准教授、東京医科歯科大学大学院医歯学総合研究科病態生化学分野の渡部徹郎教授、国立がん研究センター臨床検査科の松下弘道教授(研究当時、現:慶應義塾大学医学部臨床検査医学教室)らの研究グループによるもの。研究成果は、「Journal of Cell Biology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
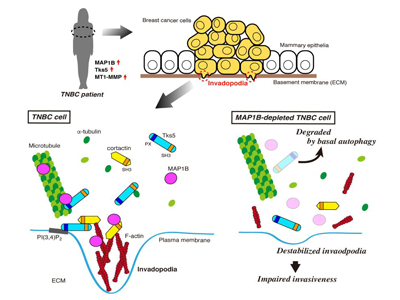
乳がんは、女性が罹患するがんの中で最も数が多く、日本では毎年9万人以上が新たに診断される。乳がんは、その特徴から大きくLuminal A、Luminal B、HER2+、トリプルネガティブ(TNBC)の4つのタイプに分けられる。そのうち、TNBCでは、がん細胞の増殖が速く、細胞が周辺の組織や他の臓器に広がる「浸潤」や「転移」に至る可能性が高いと言われている。最近では、いくつかのがんで「分子標的薬」とよばれる副作用の少ない有効な薬が開発されてきているが、TNBCでは有効な分子標的薬が少なく、治療の選択肢が限られていることから、その性質を遺伝子やタンパク質といった分子のレベルで理解し、新たな診断薬や治療薬の開発につなげることが望まれている。
がん細胞が周辺組織に浸潤していく際には、「浸潤突起」とよばれる細胞膜の微細な突起状構造を形成し、この浸潤突起に集積した細胞外基質分解酵素ががん細胞の周りのコラーゲンなどの細胞外基質を分解することで浸潤が進行する。浸潤突起は、細胞骨格タンパク質アクチンがcortactinなどの種々のアクチン制御タンパク質とともにドット状の構造体を形成し、細胞膜の特定の脂質、ここでは、ホスファチジルイノシトール3,4-二リン酸(PI(3,4)P2)に結合するタンパク質Tks5を介してそのドット状の構造体が細胞膜に繋留されることで形成される。新たに形成された浸潤突起には、細胞骨格の微小管を介した小胞輸送によりMT1-MMPなどの細胞外基質分解酵素が輸送され、浸潤突起が成熟する。
MAP1Bは発生中の脳などの中枢神経系で多く発現しているタンパク質で、アクチンと微小管の両方に結合することが知られている。この性質により、MAP1Bは神経細胞の軸索や樹状突起といった神経突起の伸長と安定化に関わっていることが知られている。しかしながら、がんとの関連についてはこれまであまり知られておらず、発現が認められるいくつかのがん細胞においてもその機能の詳細は明らかになっていなかった。
TNBC患者のがん組織でMAP1B高発現、予後にも関連と判明
研究グループは、まず、公的データベースのRNA-seqなどの情報をもとに、MAP1BがTNBC患者のがん組織やTNBC細胞株で高発現していることを見出した。実際にこれらの患者のがん組織や細胞株でMAP1BがmRNA、タンパク質レベルで高発現していることを確認した。MAP1Bの発現が多いTNBC患者のグループでは、低いグループと比べて、予後が悪いこともわかった。
RNAiやゲノム編集によりMAP1Bの発現を抑制したTNBC細胞では、in vitroやマウスモデルにおいて腫瘍の形成や浸潤活性が有意に低下した。このとき、MAP1Bの発現を抑制したTNBC細胞では、浸潤突起の形成、成熟も合わせて低下していた。
MAP1Bは浸潤突起において細胞骨格依存的にcortactin・Tks5と複合体形成
MAP1Bの一部は浸潤突起に局在しており、浸潤突起を構成するタンパク質cortactinやTks5と複合体を形成していた。MAP1BはcortactinやTks5がもつSH3ドメインに直接結合した。それら複合体の形成は、アクチン繊維や微小管の重合を阻害する薬剤で阻害されたことから、これら細胞骨格依存的であることが示唆された。
これまでTks5が浸潤突起においてアクチンの構造体と結合することは知られていたが、この研究で初めて、Tks5が微小管にも結合すること、また、PI(3,4)P2に対する結合活性を欠いたTks5(スプライシングバリアントの一つであるTks5βと相同)が微小管を束化する活性を持つことが示された。Tks5とMAP1Bの微小管への結合は相互に依存的であることも併せて明らかにした。
MAP1B抑制で、Tks5はオートファジーにより分解される
さらに、MAP1Bの発現を抑制したTNBC細胞ではTks5がオートファジー依存的に分解されることも明らかになった。
以上の結果から、MAP1Bは、TNBC細胞においてcortactinやTks5との相互作用を介して浸潤突起を正に制御しており、がんの浸潤転移を促進することが示唆された。
MAP1BやTks5関与のがん化機構なども解明し、TNBC治療薬開発につなげる予定
「予備的な実験結果から、MAP1BやTks5は今回明らかにした浸潤転移のみならず、TNBC細胞の増殖や腫瘍形成能にも関わる結果が得られており、そのような機構についても今後詳細を明らかにしていく予定。また、これらの機構を標的とした薬物スクリーニングも行なっていく。これにより、難治性TNBCの発症・病態の分子機構の一端が明らかとなり、新たな診断薬・治療薬開発につながることが期待される」と、研究グループは述べている。
▼関連リンク
・東京薬科大学 ニュース&トピックス



