ミエリンの形成に重要なMPZ、遺伝子変異がCMTを引き起こすメカニズムは未解明
横浜市立大学は9月26日、シャルコー・マリー・トゥース病(Charcot-Marie-Tooth Disease:CMT)の原因タンパク質の一つであるミエリンタンパク質ゼロ(Myelin Protein Zero:MPZ)が脂質二重膜を接着するメカニズムおよびCMTを引き起こす変異がMPZの機能と構造に与える影響を原子レベルで明らかにしたと発表した。この研究は、同大大学院生命医科学研究科機能構造科学研究室の坂倉正義准教授、高橋栄夫教授、高エネルギー加速器研究機構の田辺幹雄特任准教授、産業技術総合研究所の三尾和弘ラボチーム長らの研究グループによるもの。研究成果は、「Structure」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
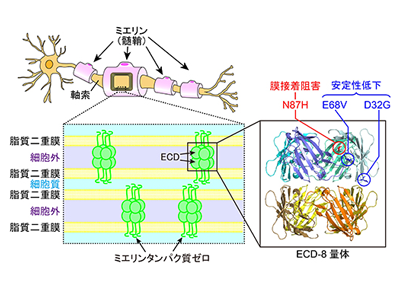
ミエリンは、神経信号が軸索を高速で伝わるために必要不可欠な、細胞でできた電気絶縁体である。末梢神経系のミエリンは、シュワン細胞が軸索の周囲に何重にも巻き付くことにより形成される。この結果生じる細胞膜(脂質二重膜)の多重層が、電気絶縁機能の本体となる。ミエリンの脂質二重膜多重層は、膜中に存在するMPZが、膜と膜を接着することにより、形成・維持されている。
MPZをコードする遺伝子DNAのミスセンス変異により、MPZを構成するアミノ酸残基の中の一つが別の種類のアミノ酸に置き換わると、ミエリンが正常に形成されず、CMTという神経疾患を発症することがある。CMTは、病気のメカニズムが十分に解明されておらず、現在までに有効な治療法、治療薬が開発されていない難病である。研究グループは、CMTの発症メカニズムを解明する第一歩として、MPZがどのようなメカニズムで膜を接着するのか、CMTを引き起こすアミノ酸残基置換が、MPZにどのような変化を引き起こすのかを明らかにしようと考え研究を行った。
X線結晶構造解析法でMPZ-ECDの立体構造を決定、2タイプの8量体形成を確認
MPZは1回膜貫通型のタンパク質で、細胞外に免疫グロブリンによく似た構造のドメイン(細胞外ドメイン:ECD)を持っている。今回の研究では、MPZによる膜接着メカニズムを原子レベルで理解するために、まずヒト由来MPZ-ECDの立体構造をX線結晶構造解析法により決定した。結晶中のECDは、リング状の4量体を形成し、さらに4量体が横に並んだtrans-8量体と、縦に並んだhead-to-head-8量体の2タイプの8量体構造を形成していた。これら2タイプの8量体は、その形から考えるといずれも膜を接着することが可能だが、実際の膜接着の場においてどちらが重要なのか、得られた構造のみから判断することはできない。
開発したナノミエリン法により、MPZのhead-to-head-8量体が膜接着に関連すると判明
そこで研究グループは、ECDの膜接着活性を評価するための新しい実験手法(ナノミエリン法)の開発を行った。ナノミエリン法では、ナノディスクと呼ばれる脂質二重膜の水溶性粒子の表面に、ECDを固定化する。野生型ECDを固定したナノディスクを調製し、電子顕微鏡で観察すると、ECDにより数珠つなぎになったナノディスク(=ナノミエリン)が観測された。この結果から、野生型ECDが膜接着活性を持っていることがわかる。次に、trans相互作用とhead-to-head相互作用に重要な役割を果たすと考えられるアミノ酸残基を、別の種類のアミノ酸に置き換えた変異型ECDをそれぞれ調製し、同様の実験を行った。すると、head-to-head相互作用面のアミノ酸残基を置き換えたW28A変異型ECDでは膜接着が起きず、ナノミエリンが形成されないことがわかった。以上の結果から、MPZは、head-to-head-8量体を形成することにより、膜と膜を接着することがわかった。
N87H変異型ECD、膜接着活性を喪失
次に、CMTを引き起こすアミノ酸残基置換をECDに導入して、ナノミエリンが形成されるかどうかを解析した。すると、4量体形成に重要なcis相互作用部位に存在する87番目のアスパラギン残基(一文字でNと表記する)をヒスチジン(一文字でHと表記する)に置き換えたN87H変異型ECDは、ナノディスクを連結することができず、変異によりECDの膜接着活性が失われたことがわかった。これは、側鎖の小さいアミノ酸であるアスパラギンが、側鎖が大きいヒスチジンに置き換わったことにより、隣のECD分子との嚙み合わせが悪くなったためだと考えられる。
膜接着活性を保持する2つの変異、タンパク質の安定性が低下しやすい
一方、CMT関連アミノ酸残基置換であるD32G変異型ECD(head-to-head相互作用面)と、E68V変異型ECD(cis相互作用界面)を導入したECDはナノミエリンを形成し、膜接着活性を保持していることがわかった。次に、円二色性分光法(CD)を用いて、これらの変異型ECDの温度依存的な構造変化を解析すると、変異型ECDが野生型ECDよりも低い温度で変性(または凝集)してしまうことがわかった。変異による安定性の低下により、細胞内で正しい構造のタンパク質ができにくくなること、あるいは細胞表面で膜接着を行うECDの「日持ち」が悪くなること、などがCMTの発症と関係すると考えられる。
今後、80か所のMPZ変異に共通するメカニズム解明が必要
今回の研究では3つのCMT関連変異がMPZ-ECDに及ぼす機能・構造変化を明らかにしたが、CMTの発症に関わるMPZ上の変異部位は80か所も見つかっている。MPZを起点としたCMTの治療薬を開発するためには、これらの変異の多くに共通するCMT誘起メカニズムを明らかにすることが必要になると考えられる。「今回開発したナノミエリン法は、多数のCMT関連変異がMPZの活性に及ぼす影響を解析する上で、有用な実験ツールになると期待される」と、研究グループは述べている。
▼関連リンク
・横浜市立大学 ニュース



