がん細胞で発現量が低下するRECK遺伝子、発がんやがんの進行への役割は不明だった
京都大学は9月19日、膵がんの発症、転移において膜タンパク質RECKの発現低下が重要な役割を果たしていることを明らかにしたと発表した。この研究は、同大医学研究科の益田朋典医員、福田晃久講師、妹尾浩教授、野田亮名誉教授らの研究グループによるもの。研究成果は、「Journal of Clinical Investigation」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
膵がんは最も予後不良ながん腫のひとつで、半数以上が診断時に遠隔転移を認める。膵がんの新規治療法の開発は社会的にも重要な喫緊の課題である。膵がんが予後不良である原因として、高率に浸潤や転移をきたす点が挙げられるが、その分子メカニズムはいまだ十分にわかっていなかった。膵発がんに重要な遺伝子変異としてKRAS、Trp53、SMAD4、CDKN2aのいわゆるBig4遺伝子などが知られている。膵がんの転移については、複雑かつ多段階のステップによって成立することがこれまでの研究から明らかになってきているが、いまだ不明な点が多く残されており、その分子機構の解明はがん治療薬開発における重要な課題である。
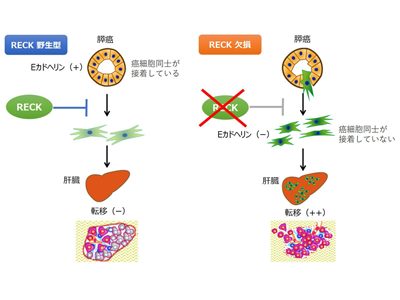
RECK(Reversion-inducing Cysteine-rich protein with Kazal motifs)は、がん遺伝子K-RASにより悪性転換したマウス線維芽細胞を正常に戻す遺伝子の探索から見出された分子である。RECKは複数の機能ドメインを持つ膜結合タンパク質で、細胞表面のタンパク質分解を抑制したり、シグナル伝達を助けたりする働きが知られている。患者組織を用いた研究では、膵がんを含む多くのがん細胞で、遺伝子変異は少ないものの、正常組織に比べ発現量が低下していることがわかっている。免疫不全マウスにヒトがん細胞株を移植するという実験系においてRECKががん細胞の浸潤、転移を抑制することが以前に示されていたが、生体内でRECK発現を消失させた時に発がんやがんの進行にどのような影響が出るのかについてはこれまで不明だった。
Kras変異に加え膵臓特異的RECK KOマウス、高率で膵がん発症・肝転移
研究グループは、膵がんにおけるRECKの機能を膵発がんマウスモデルで解析した。膵発がんモデルマウス「Ptf1a-Cre;KrasG12D;Trp53f/+」(KPCマウス)において、前がん病変である膵上皮内腫瘍性病変(PanIN)ではRECKの発現が認められたが、膵がんではRECKの発現が著しく低下・消失していた。ヒト膵がん組織でも同様にPanINではRECKが発現していたが、膵がんではRECKの発現が著しく低下・消失していた。
ヒト膵がんではほぼ全例に認められるKras遺伝子の変異を導入した、コントロールの「Ptf1a-Cre;LSLKrasG12D」(KC)マウスでは膵がんはわずか10%のマウスにしか発症しなかった。一方、Kras変異に加えてRECKを膵臓特異的にノックアウト(KO)した「Ptf1a-Cre;LSL-KrasG12D;Reckf/f」(KRC)マウスを作製した結果、KRCマウスでは高率に膵がんが発症し、肝転移もきたし、予後が短縮した。すなわち、膵臓で発現するRECKが生体内で膵がん形成を抑制していることが明らかになった。
Kras変異+p53ヘテロ欠損は肝転移を生じないが、RECK KOを加えると高率に肝転移
重要なことに、RECKをKOしたマウスに生じる膵がんはEカドヘリン(細胞同士の接着に必要な分子)の発現が著しく低下しており、組織学的に間葉系の形質を呈した。さらに、p53ヘテロ欠損を加えたコントロールのPtf1a-Cre;LSL-KrasG12D;Trp53f/+マウスでは全てのマウスで膵がんが形成されたが肝転移は生じなかったのに対して、そこにRECK KOを加えたマウスでは高率に肝転移が生じた。従って、RECKはp53欠損下においても膵がんの転移を抑制することが示された。
RECK KOマウス/細胞、Eカドヘリン低下により上皮間葉転換が誘導される
次に、膵上皮Ptf1a発現細胞を赤色蛍光タンパク質(Tomato)で標識することにより、膵上皮由来細胞のLineage tracing(細胞系譜解析)を行い、膵がんを発症する「Ptf1a-Cre;KrasG12D;Trp53f/+;LSL-Rosatd-tomato」(KPCT)マウスをコントロールとして「Ptf1a-Cre;KrasG12D;Reckf/f;LSL-Rosatd-tomato」(KRCT)マウスと比較した。KPCTマウス(コントロール)の膵がんでは間質にTomato陽性細胞は全く認められなかったのに対して、RECK KOしたKRCTマウスに生じた膵がんではTomato陽性(膵上皮由来)かつE-cadherin陰性の間質細胞が多数認められ、上皮間葉転換(Epithelial Mesenchymal Transition:EMT)が生じていることが示された。以上より、RECK KOによってマウス生体内で膵がん細胞の上皮間葉転換が誘導されることが明らかになった。
さらに、「Ptf1a-Cre;LSL-KrasG12D;Reckf/f」(KRC)マウスの膵がんからRECK KO膵がん細胞を樹立した。膵がん細胞にレトロウイルスによってRECKの再発現させた結果、浸潤能が低下した。さらに脾臓注射による肝転移モデルを用いて肝転移を評価した結果、RECK KO膵がん細胞ではEカドヘリンの発現低下を認め、肝転移の形成を無数に認めた。一方,RECK KOマウス膵がん細胞にRECKを再発現させた結果、肝転移は著明に抑制され、極少数認められた肝転移巣はEカドヘリン発現が増加し、EMT関連遺伝子(Zeb1、Zeb2、Twist1など)の発現が低下し、組織学的にも上皮様形態に変化した。これらの結果から、膵がん細胞でのRECKの再発現により上皮間葉転換、転移が抑制されることが示された。
RECKの減少でMMP3/MMP7の発現が上昇することにより、Eカドヘリン発現低下すると判明
次に、RECKがEカドヘリンの発現を制御する機序について解析した。これまでにRECKは細胞表面のタンパク質を切断するマトリックスメタロプロテアーゼ(MMPs)を抑制すること、およびマトリックスメタロプロテアーゼ(MMP3/MMP7)がEカドヘリンを切断することが報告されていた。今回、RECK KOにより、細胞表面のタンパク質を切断するマトリックスメタロプロテアーゼ(MMP2/MMP3)の発現が上昇し、Eカドヘリンの発現が減少することが示された。RECK KO膵がん細胞にMMP阻害剤を投与した結果、RECK再発現のときと同様に、Eカドヘリンの発現が増加し、上皮間葉転換マーカーの発現が低下し、浸潤能が低下した。従って、RECKはMMP2/MMP3を抑制しEカドヘリンの発現を上昇させることにより膵がんの上皮間葉転換・転移を抑制することが示された。一方、RECK KOで膵がんの発症が増加する機序については、RECK KOによりRb-E2F経路とMycの活性化が細胞増殖の亢進に寄与している可能性が示唆された。
さらに、ヒト膵がん組織の解析においても、RECK低発現のヒト膵がんはEカドヘリン発現が低く、遠隔転移が多く、分化度が低く、予後不良であることが確認された。また、解析したヒト膵がん細胞株の9種類のいずれにおいてもRECKタンパク質が発現していないことが確認された。
RECKを標的とした新規膵がん治療法の開発に期待
今回の研究により、RECKはEカドヘリンの発現を高め、膵がんの発症、上皮間葉転換、転移を抑制すること、およびRECKを再発現させることによって膵がんの転移が抑制されることが明らかになった。従って、RECKの発現を誘導する薬剤が膵がんの新規治療法になり得る可能性が示された。「今後、RECKを標的分子とした新規膵がん治療法の開発に向けて、RECKの発現を上昇させる化合物などを用いてRECKを再発現させることにより、ヒト膵がん細胞の浸潤、転移、増殖が抑制されるか検証を行っていく予定である」と、研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る



