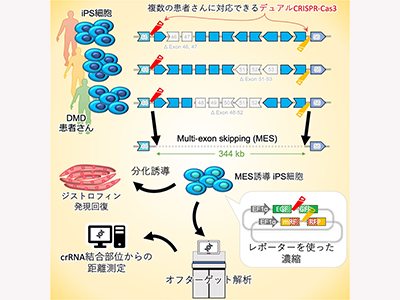
エクソン45から55標的の大規模ゲノム欠失誘導を目指す
京都大学iPS細胞研究所(CiRA)は8月25日、CRISPR-Cas3システムをペアで利用することで、さまざまなデュシェンヌ型筋ジストロフィー(DMD)患者由来のiPS細胞でジストロフィンタンパク質の発現を回復可能なマルチエクソンスキッピング(MES)を誘導する方法を開発したと発表した。この研究は、北悠人元CiRA研究員、堀田秋津准教授ら、名古屋大学大学院生命農学研究科の研究グループによるもの。研究成果は、「Stem Cell Reports」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
DMDは、筋細胞を維持するために重要な遺伝子ジストロフィンのゲノム変異により、タンパク質の読み枠が変わり(フレームシフト)、ジストロフィンタンパク質が作られなくなる筋変性疾患だ。現在のところ、根治的治療法はない。ジストロフィンタンパク質を回復させる手段の一つとして、オープンリーディングフレーム(タンパク質の読み枠)を修正するエクソンスキッピングが注目されており、エクソン53をスキップする核酸医薬品が日米で販売されている。
CiRAの堀田秋津准教授らのグループの他に、海外でも複数のグループが、CRISPR-Cas9を用いたゲノムDNAレベルのエクソンスキッピングを研究している。しかし、現在の単一のエクソンをスキッピングする方法は、限られた変異(8〜13%)にしか適用できない。2012年にマウスでの核酸医薬研究において、国立精神・神経医療研究センター(NCNP)の研究グループがエクソン45から55を標的として複数のエクソンを同時にスキップする方法(MES)であれば、DMD患者の60%以上に有効であると報告した。また、2019年、CRISPR-Cas3ゲノム編集技術が報告された。CRISPR-Cas3は狙った箇所から一方向に数kbのゲノム配列を削るという特徴を持ち、堀田准教授らのグループはMESにも利用可能であると考えた。そこで今回の研究では、デュアルCRISPR-Cas3システムを用い、エクソン45から55を標的とした大規模ゲノム欠失の誘導を目指した。
デュアルCRISPR-Cas3で344kbのDNA領域欠失に成功
1つのcrRNAで誘導されるDNA欠失は数kb程度であり、100kb以上の欠失が誘導されることはまれなため、標的とするエクソン45〜55が内側に挟まれるような一対のcrRNAを使用した。両端のcrRNA標的部位から1-2kb以内の位置(1kb、342kb)と中間地点(232kb)の位置でどの程度DNA欠失が起こっているかddPCRを用いてDNAコピー数を測定。その結果、両端と比較して中間地点までが欠失されている細胞は少なかったものの、単一のCas3/crRNAと比較して、デュアルCas3を用いることで344kbのDNA領域が欠失されている細胞を検出することができた。
デュアルCas3を用いることで大規模な欠失を誘導することが可能なものの、効率は高くなかった。編集された細胞を効率よく濃縮するために、デュアルCas3が機能した細胞だけ、2種の蛍光タンパク質(mRFPおよびEGFP)が光るようなレポーターを作成。コントロールcrRNAs(標的を切断しないcrRNA, B2M#1)と比較して、ジストロフィンのエクソン45と55を標的とするcrRNAs(ex45 & 55)を用いた場合にGFP蛍光とmRFP蛍光が観察され、このGFP/mRFP両陽性の細胞をソーティングすることで、必要な細胞群を濃縮することができた。
患者由来iPS細胞でMES誘導、ジストロフィンの発現確認
異なる遺伝子変異を持つDMD患者3名から作製したiPS細胞(FF12020、CiRA00458、CiRA00646)に、デュアルCas3システムを利用してMESを誘導した。その結果、MESの誘導をする前の細胞ではジストロフィンタンパク質が見られなかったにも関わらず、MESを誘導した細胞ではジストロフィンの発現が確認できた。また、MES誘導前後のiPS細胞で全ゲノム解析を実施して、標的以外での欠失誘導が無いことを確認した。
オフターゲット効果を起こさずジストロフィンタンパク質を回復
デュアルCas3システムを利用することで、複数のDMD患者から作製したiPS細胞において、意図しなかった欠失(オフターゲット効果)を起こすことなく、ジストロフィンタンパク質を回復させることができた。今回の方法で、大規模に標的ゲノム領域を欠失することができたが、欠失される開始点を厳密に制御することはできなかった。また、回復したジストロフィンタンパク質がどの程度機能するのか、現在のところ未確認だとしている。デュアルCas3システムを使ってゲノム編集を行ったiPS細胞は、将来、DMD患者に対して自己細胞治療へと応用する際に重要な細胞源になることが期待される。また、大規模に遺伝子を欠失させる技術は、基礎研究にも広く応用できると期待できる、と研究グループは述べている。
▼関連リンク
・京都大学iPS細胞研究所(CiRA) プレスリリース



