がん悪性化と関連報告の長鎖非翻訳RNA、作用機序は?
名古屋大学は8月23日、長鎖非翻訳RNAのTUG1について、がん細胞DNAを損傷から保護し増殖を助ける分子機構を解明したと発表した。この研究は、同大大学院医学系研究科・腫瘍生物学分野の近藤豊教授、鈴木美穂助教(筆頭著者)、飯島健太助教(研究当時、現:浜松医科大学)ら、同大大学院医学系研究科・分子腫瘍学分野の鈴木洋教授らの研究グループによるもの。研究成果は、「Nature Communications」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
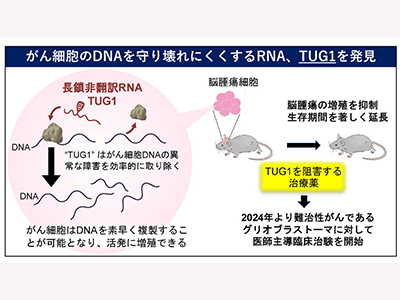
がん細胞に特徴的な高い複製ストレスは、DNA損傷とその修復過程における遺伝的エラーの可能性を高め、発がんの促進やがんの進展を加速させることがよく知られていた。しかし、がん細胞が高い複製ストレスに晒されながらも、複製を完了させ細胞増殖していく機構は完全に解明されていない。タンパク質の生成に関わらない長鎖非翻訳RNAは近年がんの発生・悪性化や薬剤耐性との関連が報告されているが、そのほとんどの機能が未知のままだ。
そこで今回の研究では、がん細胞の複製ストレスを解消し、がんの増殖を助ける機能を持つ長鎖非翻訳RNAを同定し、その作用機序を明らかにすることを目的とした。
長鎖非翻訳RNAのTUG1、複製ストレスの原因R-loop解消の機能を持つ
がん細胞の培地に、複製ストレスを引き起こす薬剤(ヒドロキシウレアとカンプトテシン)を加えると、2時間以内に長鎖非翻訳RNAであるTUG1の発現が顕著に上昇することがわかった。また、このTUG1の上昇は、がん細胞が複製ストレスに応答して活性化するATR/Chk1パスウェイの下流で起こることを明らかにした。
複製ストレスに応答して新しく発現したTUG1が核内のどこに移動するのかを調べると、R-loopというDNA構造の近傍にあることがわかった。R-loopは、転写中のRNAがDNA二重らせんの片側の鎖に結合し、もう片方の一本鎖DNAがループ状に飛び出した構造で、RNAの転写機構とDNA複製が衝突することで形成される。R-loop内の一本鎖DNAは非常に切れやすく、DNA損傷の原因となるため、TUG1は何らかの方法でR-loopを解消する役割を果たしていることが予想された。そこで、TUG1をノックダウンすると、R-loopが蓄積し、DNAが激しく損傷することがわかった。
TUG1がどのようにR-loopを解消するのかを明らかにするために、TUG1と結合し働くタンパク質を同定した。R-loopに局在するTUG1は、R-loopや停止した複製フォークに結合するRPAと、R-loop構造を分解するRNAヘリケースの一種DHX9と直接結合し、R-loopを解消していることを明らかにした。
TUG1抑制でR-loop蓄積、DNA損傷でアポトーシスによる細胞死誘導
ゲノムDNAにはさまざまな場所にR-loopが形成されやすい配列があることがわかっているが、TUG1/RPA/DHX9複合体は、特に、CAリピートを含むマイクロサテライト領域のR-loopを好んで解消することが、ゲノムワイド解析により明らかになった。マクロサテライト領域は、DNA損傷により塩基配列が容易に変異することが知られている。TUG1のノックダウンによりマイクロサテライト領域にDNA損傷を与えれば、がん細胞に人為的に変異を誘導することができる。このようなマイクロサテライト領域の変異は、ネオアンチゲンと呼ばれる免疫療法の標的をがん細胞に新たに発現させることが報告されており、TUG1を標的とした治療が、免疫療法の効果を高める可能性が示唆された。そこで、研究グループはTUG1をノックダウンした細胞について検討した。その結果、DNAが激しく損傷し、アポトーシスによる細胞死が誘導されることがわかった。
TUG1抑制の核酸医薬+テモゾロミド併用治療で抗腫瘍効果、脳腫瘍モデルマウスで
研究グループは、TUG1が脳腫瘍の一種グリオブラストーマで高い発現を示すことに注目し、TUG1の作用を抑制する核酸医薬によるグリオブラストーマへの抗腫瘍効果を、脳腫瘍モデルマウスを用いて検証した。ナノ医療イノベーションセンター、東京大学との共同研究で作製した、薬剤をがん細胞のみに到達させるための“運び屋”を、TUG1を抑制する核酸医薬と組み合わせた治療薬(TUG1-DDS)を用いることにより、TUG1を抑制する核酸医薬を脳腫瘍細胞のみに送達した。
ヒトグリオブラストーマ細胞を移植したマウスにTUG1-DDSと脳腫瘍の標準治療薬テモゾロミド(TMZ)を投与し、治療効果を確認した結果、TUG1-DDSとTMZを単独で投与したマウスと比較して、TUG1-DDSとTMZを同時に投与すると、顕著に腫瘍増殖が抑制された。そして、生存期間の著しい改善も確認された。
TUG1-DDSとTMZを同時に投与した腫瘍では、TMZによって増加したR-loopが解消されずに蓄積していた。同研究から、TUG1はがん細胞においてR-loopを解消することにより、がんのDNAを損傷から保護し、細胞増殖を助けていることを世界で初めて明らかにした。TUG1-DDSは難治性のがんである脳腫瘍において有効な治療薬となる可能性を見出すことができた。
グリオブラストーマへのTUG1-DDS医師主導治験、2024年4月開始予定
グリオブラストーマに対するTUG1-DDSの有効性を検討するための医師主導治験が2024年4月を目途に開始される。TUG1-DDSは脳腫瘍で初めての長鎖非翻訳RNAを標的とする核酸医薬であり、新規治療薬としての効果が期待される、と研究グループは述べている。
▼関連リンク
・名古屋大学 プレスリリース



