従来法では、挿入・欠失がランダムかつ高頻度で発生するなど安全性に課題
筑波大学は6月28日、ゲノム編集を行った造血幹細胞を1個から増殖させるクローン培養システムを開発したことを発表した。この研究は、同大医学医療系の山崎聡教授らの研究グループによるもの。研究成果は、「Cell Stem Cell」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
造血幹細胞では、血液細胞、すなわち、体内に存在するすべての免疫細胞および血球細胞(赤血球・白血球・血小板)が作られる。血液細胞に起因する疾患は多く存在するが、中でも遺伝的にDNAの変異が病気を引き起こす鎌形赤血球症、重症複合型免疫不全などがよく知られている。その治療法として、造血幹細胞を対象とした「遺伝子治療」が期待されている。
近年の遺伝子治療分野における最も凄まじい進歩の一つは、CRISPR/Cas9によるゲノム編集技術である。これを用いると、細胞のゲノムに外来DNAを挿入し、病気の原因となる変異を修正することができる。このようにして機能を回復した細胞を移植して、病気の治療を行う。
CRISPR/Cas9でゲノム編集を行う際にはDNA二本鎖切断が生じるが、それを修復する経路として、一般的にHDRとNHEJの2種類がある。HDRは、テンプレートを用いて正確に修復する経路で、ゲノム編集に応用されている。それに対してNHEJは、切断されたDNAの末端同士を結合して修復する経路で、その過程では、小さい「挿入や欠失(indel)」がランダムかつ高い頻度で発生し、遺伝子の機能が失われたり、有害変異が導入される可能性がある。また最近、HDRとNHEJ以外の経路で、ゲノムの安定性を損なう「数百-数千塩基に及ぶ欠損(Large deletion)」が起きることが報告されている。
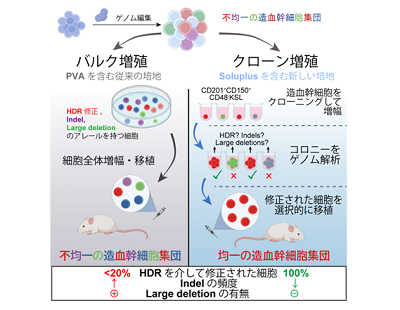
造血幹細胞においてはHDRよりNHEJが優位とされることから、HDRを介して目的の編集が導入されている細胞は2〜3割程度に止まり、残りの7〜8割は非特異的なIndelやLarge deletionを持つ細胞や編集されていない細胞となる。つまり、従来の方法でゲノム編集された造血幹細胞のほとんどは、目的の編集を持たず、機能せず安全性も不明な細胞ということになる。そこで研究グループは、この問題に取り組むために、造血幹細胞の単一増幅技術の開発を目指した。
バルク増幅を用いたゲノム編集方法、目標通りの編集を持つ細胞の割合は低いと確認
まず、造血幹細胞でゲノム編集を行うとどのような変異が起こるかを調べるために、研究グループが2019年に報告した培養プロトコルを用いて、Prkdc遺伝子に変異を持つSCID免疫不全マウス由来の造血幹細胞をバルク増幅した。SCID変異を修正するためにゲノム編集を行い、これをSCID免疫不全マウスに移植したところ、7日間後の時点で、造血能力が高い造血幹細胞の数は約9倍に増えた。ゲノムを解析すると、HDRを介したSCID変異の修正、NHEJによるIndel、未編集のアレルが、2:5:3の割合で混在していることが確認された。
さらに、移植4週間後から免疫細胞が末梢血や胸腺、脾臓に出現した。これらはゲノム編集で修正された幹細胞から分化したものと考えられた。しかし、体内で分化した血球の一部にもIndelが検出され、この細胞ではPrkdcは正常に機能していないことが予想された。つまり、バルク増幅を用いたゲノム編集方法では、目標通りの編集を持つ細胞の割合は低いことが問題であるとわかった。
培地を変更し、ゲノム編集を行った造血幹細胞を1個から約3万倍に増殖可能に
Indelは遺伝子治療においても問題を引き起こす可能性があるため、できるだけ除去する必要がある。そこで、単一の造血幹細胞(クローン)を特定・増殖して、各クローンからできた細胞集(コロニー)でゲノム解析を行う方法を考えた。こうすることにより、設計した編集の有無を確認した上で、クローンを選択して移植することができ、望ましくない変異を持つクローンを除去することが可能になる。
しかし、従来のPVA(ポリビニルアルコール)を用いた培養系では、造血幹細胞のクローン増殖の頻度は低かったことから、培地としてより優れたポリマーのスクリーニングを行った。その結果、PCL-PVAc-PEG(ポリビニルカプロラクタム-ポリ酢酸ビニル-ポリエチレングリコールグラフトコ3ポリマー)を用いると、健常のマウス(免疫不全マウスではない)の造血幹細胞において、1個の細胞から約3万倍も増殖ができることを見出した。
目的の編集をもつクローンを選定しモデルマウスに移植、7割以上のアレルがHDRで修復
このPCL-PVAc-PEGを培地とした増殖システムを、SCIDゲノム編集モデルに適用した。上述の実験と同様に、SCIDマウスから造血幹細胞を3日間バルク増殖した後にゲノム編集を行い、さらに4日間培養して、造血能力が高いと思われるCD201+CD150+CD48-KSL分画から細胞をクローニングし、2週間後にSCID変異の修正とIndelの有無をスクリーニングした。その結果、約100個のクローンのうち、修正されたアレルを少なくとも1つ持つクローンは50%、Large deletionを有するクローンも約50%だった。その中から、変異が修正されていたクローンだけを選択してSCIDマウスに移植した。すると、バルク増殖法と同様に、移植4週間後から末梢血で免疫細胞が見られた。さらに、血球を解析したところ、7割以上のアレルがHDRで修復されており、NHEJによるIndelは見られなかった。これは従来のバルク増殖法とは大きく異なる点である。
免疫系の回復も確認
SCID変異が修正された造血幹細胞が、本当に機能的な免疫細胞を作り出せるかを確認するために、ヒト腫瘍細胞を皮下投与すると、修正された造血幹細胞を移植したマウスだけが腫瘍細胞を拒絶したため、免疫系が回復していると結論づけた。
「造血疾患に対するゲノム編集技術を用いる遺伝子治療は、今後ますます広がると予想される。今回開発したクローン増殖方法は、造血幹細胞におけるゲノム編集の有効性と安全性を高めることができる点で、ヒトの遺伝子治療に非常に有用であると考えられる」と、研究グループは述べている。
▼関連リンク
・筑波大学 TSUKUBA JOURNAL



