従来の気管支オルガノイドは管腔側が隠れておりSARS-CoV-2感染が不十分
京都大学iPS細胞研究所(CiRA)は5月30日、ヒト気管支モデルの開発と新型コロナウイルス感染症(COVID-19)創薬への応用を行ったことを発表した。この研究は、CiRA増殖分化機構研究部門の佐野絵美研究員、橋本里菜研究員、高山和雄講師、大阪大学微生物病研究所の鈴木達也助教、岡本徹教授らの研究グループによるもの。研究成果は、「Communications Biology」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
大規模かつ高精度にCOVID-19創薬研究を実施するためには、ヒト呼吸器を忠実に再現したin vitro(生体外)呼吸器モデルが不可欠だ。気管支オルガノイド(BO)および肺胞オルガノイドは、生体の呼吸器を忠実に模倣できる優れたツールであるため、COVID-19創薬研究への応用が期待されている。BOは生体の気管支と同様に、線毛細胞、クラブ細胞、ゴブレット細胞、基底細胞から構成されている。しかし、マトリゲルのようなゲルの中で培養されているBOにSARS-CoV-2を感染させても、気管支の管腔側が球体のオルガノイドの内側に沈み込んでいるため、十分な感染効率が達成できない。そこで、気液界面培養(ALI)を行うことにより、管腔側からのウイルス感染を行うことが可能になる。
気液界面モデルBO-ALIで管腔側を表出、ウイルス感染効率2,000倍
今回、研究グループは、BOを作製したのち、BO由来のALIモデルを開発し、さまざまなCOVID-19創薬研究が実施できるか検討した。
まず、BOを正常なヒト気管支上皮細胞から分化させた。50μLのマトリゲルの中には約100個のBOがあり、BOの直径は約100〜200 μmだった。電子顕微鏡や免疫染色により、作製したBOは生体の気管支と同様に、基底細胞、線毛細胞、ゴブレット細胞、クラブ細胞で構成されていた。以上の結果から、ヒト気管支上皮細胞からBOが作製できることがわかった。
次に、BOを新型コロナウイルス(SARS-CoV-2)に感染させたのち、5日間培養した。球状のBOにSARS-CoV-2を感染させた場合と比べて、単細胞にまで分散させたBOにSARS-CoV-2を感染させた方が、ウイルス感染効率が高いことを確認した。球状BOの感染効率が低いのは、SARS-CoV-2がBO内腔にある線毛細胞にアクセスできないためだと予想された。
気管支の管腔側からのウイルス感染を模倣するために、気液界面培養を用いて、BOでは内側にもぐりこんでいた線毛細胞が外側に並んだ気管支オルガノイド由来の気液界面モデル(BO-ALI)を作製。BO-ALIおよびBOにSARS-CoV-2を感染させたのち、培養上清中の感染性ウイルス量を測定したところ、BO-ALIの方がBOよりも2,000倍ほど多いことがわかった。
SARS-CoV-2は線毛細胞に感染、基底細胞は破壊された気管支上皮の再生に寄与
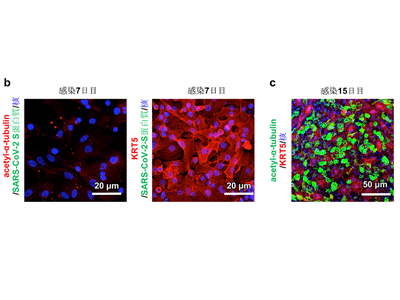
このとき、SARS-CoV-2 Sタンパク質は線毛細胞のみで確認され、基底細胞ではほとんど確認されなかった。これらの結果から、SARS-CoV-2は基底細胞よりも線毛細胞に優先的に感染することがわかった。
ウイルス感染から1週間培養を継続すると、acetylated α-tubulin陽性線毛細胞およびSARS-CoV-2 Sタンパク質陽性細胞は観察されなかった。これは、ウイルス感染により線毛細胞が死滅したことを示唆している。一方で、KRT5陽性基底細胞はウイルス感染後1週間後でも生存していた。ウイルス感染から15日後、生き残った基底細胞はacetylated α-tubulin陽性の線毛細胞に分化し、再び気管支上皮細胞層を形成していた。これらの結果は、ウイルス感染により破壊された気管支上皮細胞層の再生過程において、基底細胞が重要な役割を果たすことを示唆している。
BO-ALIを用いて治療薬の評価や感染メカニズムの解析が可能
次に、BO-ALIを使用してCOVID-19治療薬の有効性を評価した。感染したBO-ALIにカモスタット、レムデシビル、モルヌピラビルをそれぞれ作用させたところ、培養上清中の感染性ウイルス量の有意な減少が確認できた。また、BO-ALIにオミクロン株を含む8種類のSARS-CoV-2のバリアント(B、B.1、B.1.1.214、B.1.1.7、B.1.351、P.1、B.1.617.2、B.1.1.529)を感染させると、いずれのバリアントについても培養上清中のウイルスゲノム量が経時的に増加していた。BO-ALIにおいてオミクロン株は他の変異株と比べてやや感染効率が低かった。以上より、BO-ALIは、COVID-19治療薬の有効性評価やSARS-CoV-2のバリアントごとの解析研究に使用できることがわかった。
臓器チップ技術、動物モデル、免疫細胞モデルなどを組み合わせて幅広く応用可能
今回の研究では、SARS-CoV-2研究に使用可能なBOとBO-ALIが開発された。今回開発したBOとBO-ALIは静止した状態で培養されているが、ヒトの体内の呼吸器は、気流によるせん断応力や呼吸による伸縮刺激に常に晒されている。せん断応力や伸縮刺激を人工的に作り出せる臓器チップ(Organs-on-a-chip)技術を用いることにより、BOやBO-ALIの機能をさらに生体に近づけることが可能だと期待される。研究グループは、同研究で用いたオルガノイド技術に加えて、臓器チップ技術も用いたモデル開発を行うことで、より高度な感染症創薬が実施できるようになると想定している。
同研究では、基底細胞がウイルス感染後の破壊された気管支上皮細胞層の再生に重要な役割を担うことを明らかとなり、そのプロセスでFGF10が必須であることが確認された。したがって、FGF10はウイルス感染によって損傷した気管支の再生に有効であることが期待される。また、基底細胞そのものを移植することで、ウイルス感染によって損傷した気管支の再生を促進する可能性が示唆される。しかし、FGF10や基底細胞を用いたCOVID-19の治療法を開発するためには、今後動物モデルを用いたin vivo(生体内)解析も必須だ。
BO-ALIを用いた検討では、気管支上皮細胞層の破壊と再生を再現できたが、気管支炎や炎症細胞浸潤などは模倣できていない。炎症を再現するには、免疫細胞を含むモデルを新規に開発する必要がある。今後、BOやBO-ALIに加えて免疫細胞を含むモデルを構築することにより、炎症の再現および抗炎症薬の開発も可能になると期待される。
▼関連リンク
・京都大学iPS細胞研究所 ニュース



