がん細胞が死を回避するブレーキ役に着目
神戸大学は1月4日、がん細胞が死を回避するメカニズムの一端を解明したと発表した。この研究は、同大学大学院医学研究科の梶本武利助教、中村俊一教授らの研究グループが、カリフォルニア大学サンディエゴ校のアレキサンドラ ニュートン教授、アンドリュー マキャモン教授らと共同で行ったもの。研究成果は、米国際学術誌「Science Signaling」のオンライン版に、1月1日に掲載された。
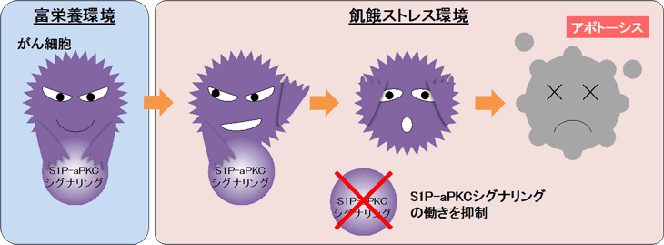
がんの治療に用いられている多くの抗がん剤は、がん細胞のDNAをさらに損傷させて「アポトーシス」と呼ばれる細胞死を起こさせている。一方で、アポトーシスを回避するさまざまなメカニズムを備える全てのがん細胞を死へ導くことは難しく、治療抵抗性の一因として課題視されていた。がん細胞が死を回避する「ブレーキ役」を制御できれば、選択的で副作用の少ない新たながん治療ターゲットになると期待されている。そのため、細胞死回避のメカニズムを明らかにする研究が盛んにおこなわれている一方で、細胞死回避をターゲットとするがん治療薬は、まだ開発されていない。そこで研究グループは、創薬に直結する分子の立体構造情報の取得も含めた、新たな細胞死回避メカニズムの解明を目指した。
S1PとaPKCの直接作用による細胞内シグナリングを発見
研究グループは、がん細胞の生存に関わると知られている細胞内シグナルタンパク質である非典型プロテインキナーゼC(aPKC)に着目。まず、上皮がん由来のがん細胞を用いてaPKCの働きを抑えてみたところ、アポトーシスが誘導された。これにより、aPKCが、がん細胞の死のブレーキ役として働いているとわかった。次に、がん細胞死のブレーキ役としてのaPKCの活性制御メカニズムを明らかにするために、緑色蛍光タンパク質を用いてaPKCに選択的な分子センサー(aPKCセンサー)を開発し、生きた細胞でaPKCの働きを色で見分けられる実験系を構築した。このaPKCセンサーを用いて、がん細胞で恒常的にaPKCを活性化させる因子を探索した。その結果、スフィンゴシン1-リン酸(S1P)がaPKCに直接結合して活性化させると判明した。S1Pは多くのがんにおいてその産生量が増加していることが知られている。
画像はリリースより
さらに、創薬に向けてS1PとaPKCの結合様式を分子構造情報として明らかにするために、タンパク質立体構造データベース上のaPKCの結晶構造を用いてS1Pとの誘導適合ドッキングシミュレーション解析を行った。この解析により、aPKC上の正の電荷を持つアミノ酸がS1Pの結合に必要であると予測された。また、遺伝子操作により、予測されたアミノ酸の機能を失くした「aPKC変異体」を作製し、aPKCセンサーを用いて細胞内でのaPKC活性を観察したところ、S1Pによる活性化のみが消失していた。また、このaPKC変異体は、飢餓ストレス環境下でもがん細胞がアポトーシスを回避して生き延びてしまう能力が失われ、細胞死を起こすようになっていた。以上の結果から、特定のアミノ酸を介してS1Pが直接aPKCに作用し、恒常的な活性化を起こすこと(S1P-aPKCシグナリング)が、がん細胞をアポトーシスから回避するブレーキ役として働いていることが判明した。
これらの成果により細胞死のブレーキ役が分子の「形」のレベルで明らかになった。今後この分子構造情報を基にがん細胞死のブレーキを解除する新たな分子標的薬の探索・設計が可能になると期待される。
▼関連リンク
・神戸大学 研究ニュース



