認知症発症前から進行するタウタンパク質線維化、そのメカニズムは未解明
東京都立大学は10月16日、タウタンパク質が線維化する前に数十nmの大きさを持つ巨大な「前駆体クラスター」を形成することを明らかにしたと発表した。この研究は、同大大学院理学研究科の高橋知未氏(博士後期課程)、栗田玲教授、東京都医学総合研究所の野中隆認知症研究プロジェクトリーダー、東京大学大学院薬学系研究科の富田泰輔教授らの研究グループによるもの。研究成果は、「Neuroscience Research」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
アルツハイマー病は、記憶や認知機能が徐々に失われていく代表的な神経変性疾患で、世界的に患者数が増加している。病気の脳には大きく二つの特徴的な変化が見られる。一つはアミロイドβが固まってできる「老人斑」、もう一つはタウタンパク質が線維化して神経細胞の中に蓄積する「神経原線維変化」である。
これまで多くの研究はアミロイドβに注目し、凝集の仕組みや中間体を標的とした薬の開発が進められてきた。一方で、タウタンパク質の線維化は認知症の発症前から進行することが知られており、アミロイドβだけでなくタウタンパク質を直接抑える治療戦略が求められている。
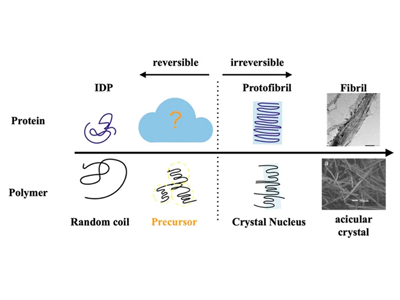
タウタンパク質は「天然変性タンパク質」と呼ばれる、柔軟で形が定まらない分子であり、同じような性質を持つαシヌクレインやTDP-43もパーキンソン病やALSなどの病気に関わっている。これらのタンパク質がどのように秩序だった線維へと変化するのかは、物理学的にも重要な未解明の課題だった。
タウ線維化を解析、「前駆体」段階で巨大クラスター形成を確認
研究グループは、タウタンパク質の凝集を理解するために「高分子物理」の視点を導入した。高分子結晶の研究では、無秩序な鎖状分子が結晶になる際に「前駆体(プレカーサー)」と呼ばれる中間的な状態を経由することが知られている。この前駆体は結晶化の進み方や最終的な構造を決定づける重要な存在であり、物性物理学の分野では広く受け入れられた概念である。研究グループは、同じような物理法則が「天然変性タンパク質」であるタウの線維化にも当てはまるのではないかと考えた。
タウタンパク質はヘパリンを添加したのち、震とうすると線維化することが知られている。タウタンパク質にヘパリンを添加した溶液をX線小角散乱(SAXS)を用いて調べたところ、タウタンパク質が線維とは異なる巨大な「前駆体クラスター」を形成していることが明らかになった。このクラスターはアミロイド線維のように硬く固定された構造ではなく、可逆的に形成と解体を繰り返す特性を持っていた。
NaCl添加による前駆体クラスター破壊、タウの線維化を抑制
さらに重要なのは、このクラスターを人為的に壊すと線維化が抑制された、という点である。具体的には、溶液に塩化ナトリウム(NaCl)を加えることで、タウと陰性高分子(ヘパリン)との静電的な結合が阻害され、形成されたクラスターが崩壊した。その結果、タウの線維化は著しく遅れるか、ほとんど進まなくなることが確認された。
新たな治療戦略の可能性を示唆、他の神経変性疾患への応用も期待
タウタンパク質の線維化過程において「前駆体クラスター」は線維化を促進する中間段階であり、しかも可逆的に操作できる「治療的に狙いやすいポイント」であることが示された。高分子物理において前駆体が結晶構造を決めるように、神経変性疾患に関わる天然変性タンパク質でも前駆体が病理的な線維化の方向性を左右すると期待される。
今回の成果は、アルツハイマー病研究において「完成した線維」から「その手前の可逆的な前駆体」へと注目点を大きくシフトさせるものである。「これは、タウの凝集を抑制する新しい治療戦略の基盤になる可能性があり、さらにパーキンソン病のαシヌクレインなど、他の神経変性疾患に関わるタンパク質の理解や治療法開発にも広く応用できると期待される」と、研究グループは述べている。
▼関連リンク
・東京都立大学 ニュース・イベント



