食べ物や環境は腸上皮幹細胞の働きに影響するが、その仕組みの多くは未解明
徳島大学は10月31日、腸幹細胞で特異的に発現するE3ユビキチンリガーゼであるRNF32がカルシウム依存的に活性化し、IκBキナーゼ(IKK)複合体を介してNF-κBシグナルを制御することを発見したと発表した。この研究は、同大大学院医歯薬学研究部薬学域口腔科学部門口腔生命科学分野、フォトニクス健康フロンティア研究院の工藤保誠教授、毛利安宏講師、猿棒元陽氏(歯学科6年生)らと、ヴェローナ大学のDaniele Guardavaccaro教授らの研究グループとの共同研究によるもの。研究成果は、「Molecular Cell」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
ヒトの体では、さまざまな組織が常に新しく生まれ変わっている。中でも腸の内側を覆う「腸上皮」は、わずか4~5日で入れ替わるほど再生能力が高い組織だ。腸の表面では古くなった細胞が次々と剥がれ落ちるが、腸のくぼみ(陰窩)の奥にある幹細胞が新しい細胞を生み出すことで、腸の健康とバランスが保たれている。
これまでの研究で、食べ物や環境が腸上皮幹細胞の働きに影響することがわかっているが、その仕組みの多くはまだ明らかになっていない。
腸上皮幹細胞に特異的に発現するE3ユビキチンリガーゼ「RNF32」を発見
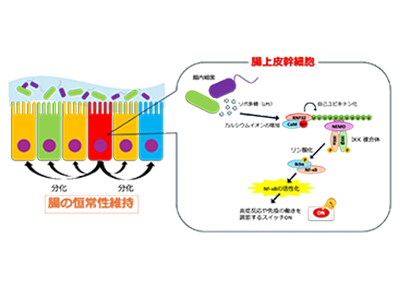
NF-κBという分子は、体の中で炎症反応や免疫の働きを調節するスイッチのような役割を担っている。普段は休んでいるが、細菌やウイルス、ストレスなどの刺激を受けると活性化し、多くの遺伝子を動かして細胞の防御反応を起こす。
今回研究グループは、腸上皮幹細胞に特異的に発現するE3ユビキチンリガーゼ「RNF32」を発見し、NF-κBを活性化する上で重要なIκBキナーゼ(IKK)複合体の働きを制御することを明らかにした。E3ユビキチンリガーゼは、細胞内のタンパク質に「ユビキチン」という分子の鎖を付けること(ユビキチン化)で、その分解や活性化、相互作用、局在を調節する酵素で、細胞の移動やDNA修復、シグナル伝達などさまざまな生命活動を支えている。
RNF32が腸の免疫や防御反応に不可欠、欠損したマウスで腸の健康維持に異常
RNF32はカルシウムセンサーである「カルモジュリン」に依存して活性化され、細胞内カルシウムイオン濃度の上昇によりカルモジュリンと結合して自己ユビキチン化を受ける。さらに、RNF32が作るユビキチン鎖がIKK複合体の制御因子「NEMO」を呼び寄せることで、NF-κBシグナルを作動させる。また、カルシウム濃度の上昇に伴いRNF32が「相分離」による凝集構造を形成し、これがNEMO凝縮体の形成を促すことでIKK活性化に必須の場となることもわかった。RNF32は細菌由来のリポ多糖(LPS)によるNF-κB活性化にも必要であることが示された。
さらに、RNF32は腸上皮幹細胞で特に多く発現しており、RNF32が欠損したマウスでは、腸の細胞構成が乱れ、病原体から腸管上皮を守るパネート細胞が減少し、粘液を作る杯細胞が増加するなど腸の健康維持に異常が生じた。これは、NF-κBが働かない場合に見られる腸の異常と類似しており、RNF32が腸の免疫や防御反応に不可欠であることを示している。
RNF32は腸の炎症やがんに対する新しい治療標的や予後マーカーとなる可能性
ヒト腸組織のデータ解析により、RNF32は胃や大腸のがんで高く発現しており、RNF32の異常は、大腸がん患者の生存率低下と関連していることがわかった。これらのことから、RNF32は腸の炎症やがんに対する新しい治療標的や予後マーカーとなる可能性がある。
以上の成果により、RNF32が腸上皮でのNF-κBシグナル制御において、従来知られていなかった新しいメカニズムを担っていることが明らかになった。
腸の炎症を抑え、組織の修復を促す次世代型の幹細胞標的治療薬の開発を目指す
RNF32が腸幹細胞におけるNF-κBシグナルを制御する新しい仕組みを明らかにしたことで、炎症や再生のバランスを分子レベルで理解する道が開けた。
「今後は、RNF32を介した経路が炎症性腸疾患(潰瘍性大腸炎やクローン病)や大腸がんの発症にどのように関与するのかを詳細に解析する。さらに、RNF32の活性を調節する化合物の探索を進め、腸の炎症を抑え、組織の修復を促す次世代型の幹細胞標的治療薬の開発につなげていく」と、研究グループは述べている。
▼関連リンク
・徳島大学 プレスリリース



