がん細胞は酸化ストレス回避により生存能力を高める
東北大学は8月22日、肝がん細胞が「セレン代謝」を組み替えて細胞死を回避する仕組みを解明したと発表した。この研究は、同大大学院薬学研究科の有澤琴子助教、平沼哲太氏、名取萌花氏、斎藤芳郎教授らの研究グループによるもの。研究成果は、「Redox Biology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
肝細胞がんは世界的に発症頻度が高く、予後不良な悪性腫瘍の一つ。がん細胞は酸化ストレスを回避することで生存能力を高めており、治療抵抗性や再発の原因となっている。酸化ストレス防御に重要な役割を果たすのが、必須微量元素セレンを含む「抗酸化セレンタンパク質」だ。
セレン輸送を担う「SeP」、肝細胞がんで減少するのはなぜか?
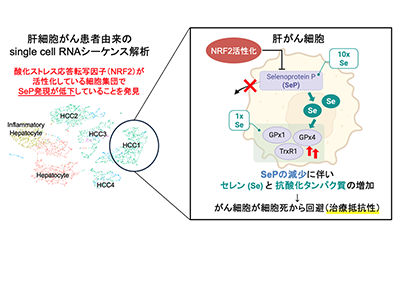
セレンは、体内で酵素やタンパク質の構成成分として働く。その中には、グルタチオンペルオキシダーゼ(GPx)やチオレドキシン還元酵素(TrxR)などの酸化ストレスから生体を防御する重要な酵素も含まれる。食事から摂取したセレンは血液を通じて全身に運ばれるが、その主要な輸送を担うのが、肝臓で産生される「セレノプロテインP(SeP)」である。SePは1分子あたり10個のセレンを保持するタンパク質であり(他のセレンタンパク質は1~2個)、セレンの分配に重要な役割を果たしている。
これまでに研究グループは、SePの低下あるいは増加が、さまざまな疾患リスクと関連することを報告してきた。例えば、SePの増加によって糖代謝が悪化することを明らかにしている。近年、肝細胞がん組織や血中でSePの低下が報告され、バイオマーカーとして注目されている。しかし、なぜがん細胞でSePが減るのか、その減少ががん細胞の生存や治療抵抗性にどう関わるのかは不明だった。
そこで今回の研究では、SeP減少のメカニズムを分子レベルで解明し、その生物学的意義を明らかにすることを目指した。
肝細胞がんではNRF2がSeP発現抑制、細胞内セレン量を高めて抗酸化タンパク質を維持
まず、データベースを用いてヒト肝細胞がん組織のsingle-cell RNAシーケンス解析を行い、酸化ストレスに応答する転写因子NRF2の活性が高いがん細胞クラスターにおいてSeP発現が低下していることを見出した。NRF2は通常、酸化ストレスから細胞を守る遺伝子群を活性化するが、がんでは過剰に働き、治療抵抗性や腫瘍進展に寄与することが知られている。
次に、培養肝がん細胞(HepG2細胞)を用い、NRF2を薬剤および遺伝子改変で活性化したところ、SeP発現が顕著に抑制され、細胞内セレン量が増加した。この変化に伴い、セレン依存的に合成される抗酸化セレンタンパク質であるGPx1やGPx4の発現がタンパク質レベルで維持された。NRF2がSePを減少させること自体は、同研究グループが過去の研究で既に報告していたが、それが細胞内のセレン分布を変化させ、SePの発現制御に直結していることを明らかにしたのは、今回の研究が初めてである。
SeP抑制によるフェロトーシス回避、がん細胞の酸化ストレス耐性を高める新たな経路
さらに、CRISPR/Cas9技術でSeP遺伝子を欠損させた細胞を作製すると、細胞内にセレンが蓄積し、GPx1やGPx4の発現が増加した。この細胞では脂質過酸化物の蓄積が抑えられ、鉄依存的な細胞死である「フェロトーシス」に対する抵抗性が高まっていた。同様の傾向はマウスモデルでも確認され、SeP遺伝子欠損マウスでは肝臓中のセレンとGPx1が顕著に増加した。
フェロトーシスは近年、がん細胞を死滅させる新しい治療戦略として注目されている。同研究によって、がん細胞がSePを抑えることで細胞内セレンを保持し、抗酸化能力を高めてフェロトーシスを回避している可能性が示された。今回明らかになったNRF2がSeP発現を抑制し、セレン代謝を組み替えて酸化ストレス耐性を高める一連の経路は、がん治療の新しい治療標的となることが期待される。
セレン代謝を標的とする新たな治療戦略、がん種による違いは検討が必要
同研究は、がん細胞が自らセレンの利用方法を変えて酸化ストレス耐性を高める仕組みを解明し、SePやNRF2を標的とした新たな治療戦略の可能性を示した。特に、SePを抑制して細胞内にセレンを再配分することで、抗酸化セレンタンパク質の増加を制御できる可能性は、がん細胞を酸化ストレスに弱い状態へ導く「セレン代謝改善戦略」として注目される。一方で、SePの役割はがん種によって異なるため、SePを標的とする治療戦略はがん種ごとの特性を考慮して設計する必要がある。
「本成果は、SePを用いたがんの診断・予後予測法の開発や、予防・再発防止への応用にもつながると期待される」と、研究グループは述べている。
▼関連リンク
・東北大学 プレスリリース



