SLC29A3異常のマクロファージ、リソソーム内ヌクレオシド蓄積で増殖誘導の仕組みは?
東京大学医科学研究所は7月19日、家族性組織球症の一つである「SLC29A3異常症」の病態を解明したと発表した。この研究は、同研究所感染遺伝学分野の三宅健介教授、柴田琢磨准教授、東京大学大学院薬学系研究科の清水敏之教授、東京都立大学大学院理学研究科の田岡万悟准教授らのグループによるもの。研究成果は、「Journal of Experimental Medicine」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
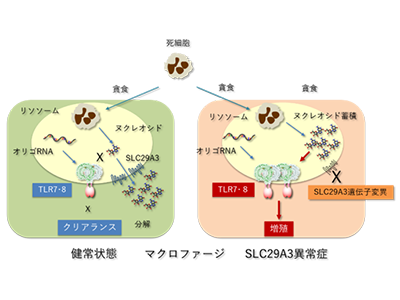
ヌクレオシドトランスポーターである「SLC29A3」は主にマクロファージに発現し、リソソームに局在している。死細胞の貪食などによりマクロファージのリソソームに取り込まれたDNAやRNAは、リソソーム内の分解酵素によりヌクレオシドにまで分解される。その後、リソソーム内ヌクレオシドはSLC29A3を介して細胞質側に輸送され、不用なヌクレオシドはさらに分解されて細胞外へと排出される。このSLC29A3の遺伝子に機能欠損型変異が生じることで、SLC29A3異常症が起こる。
SLC29A3異常症は、マクロファージが多臓器に蓄積する組織球症を特徴とした疾患。SLC29A3異常症のモデルとして報告されているSLC29A3欠損マウスでも、ヒトと同様にマクロファージが全身に蓄積している。このSLC29A3欠損マウスにおいて、マクロファージのリソソーム内にヌクレオシドが蓄積してしまうことはわかっていたが、蓄積したヌクレオシドがマクロファージの増加をどのように誘導するのかは解明されていなかった。
研究グループでは、自然免疫応答を司る「Toll様受容体F(Toll-like receptor:TLR)」についての解析を一貫して進めてきた。TLRファミリーのメンバーは、主にマクロファージや樹状細胞に発現し、病原体由来の脂質、タンパク質、核酸に応答することで感染防御反応を誘導する。核酸を認識するTLRは細胞表面ではなくリソソームに局在しており、核酸認識TLRの中でもTLR7とTLR8は1本鎖RNAのセンサーとして機能する。研究グループはこれまでに構造生物学的および分子細胞生物学的な解析を介して、TLR7とTLR8が1本鎖RNAそのものではなく、その分解産物であるヌクレオシドとオリゴRNAに結合することで活性化されることを明らかにしてきた。
SLC29A3異常症のマクロファージ増殖はTLR7活性化で誘導、マウスで確認
TLR7とTLR8がヌクレオシドに応答するという研究結果を受け、研究グループは今回、SLC29A3異常症の解析に着手した。つまり、SLC29A3異常症ではマクロファージに発現するTLR7やTLR8がリソソームに蓄積したヌクレオシドに応答してしまい、結果としてマクロファージの増殖が誘導されてしまう可能性があると考えた。
マウスではヒトと異なり、TLR7とTLR8のうちTLR7のみが一本鎖RNAのセンサーとして機能している。そこで、SLC29A3欠損マウスとTLR7欠損マウスの交配により「2重遺伝子欠損マウス」を作成したところ、マクロファージの増加・蓄積によって引き起こされる脾臓の腫大は完全に消失した。また、脾臓におけるマクロファージを調べたところ、SLC29A3欠損マウスにおいて認められたマクロファージの増殖亢進もTLR7の欠損により完全に消失していたという。これらの結果は、SLC29A3欠損マウスにおける組織球症の誘導がTLR7の活性化により引き起こされることを明確に示している。
ヒトにおける組織球症の病態誘導には、ヒトTLR8が関与の可能性
次に、ヒトSLC29A3異常症の患者検体を解析したところ、末梢血単球から誘導したマクロファージでは健常人由来マクロファージに比べて生存・増殖が亢進していることが判明した。マウスとは異なり、ヒトの単球・マクロファージではTLR7よりもTLR8の発現および機能が強いことから、ヒトTLR8がマクロファージの増殖誘導を起こす可能性を検討した。
その結果、SLC29A3異常症において亢進したマクロファージの生存・増殖はTLR8拮抗剤により強く抑制された。ヒトTLR8がSLC29A3異常症の原因となり得ることを示すため、マウスモデルを用いてさらにヒトTLR8の機能解析を行った。SLC29A3とTLR7の2重遺伝子欠損マウスのマクロファージにヒトTLR8を発現させたマウスを作製したところ、マクロファージの増加および脾臓の腫大が明らかに認められた。これにより、マウスTLR7と同様に、ヒトTLR8もマウス生体内において組織球症を誘導し得ることが示された。これらの結果から、ヒトにおける組織球症の病態の誘導にはヒトTLR8が関与する可能性が高いと考えられた。
TLR7/8を標的とした新規治療薬の開発に期待
組織球症では、マクロファージがなぜ増加するのかに関してこれまでも解析が進められてきている。炎症の結果として増殖が起こる可能性も考えられていたが、がん細胞で認められるような増殖を亢進する遺伝子変異が組織球症で蓄積したマクロファージでも検出されており、それらの遺伝子変異がマクロファージの異常な増殖や蓄積を起こすという考えが現在の主流だ。
今回の研究により、組織球症の中でも家族性組織球症というまれなタイプにおいて、マクロファージの増殖がヌクレオシドに対する病原体センサーTLR7、TLR8の応答によって誘導されることが世界で初めて示された。同結果は、TLR7やTLR8を標的とした全く新しい組織球性疾患治療法の可能性を示したと言える。
「この結果は、希少なタイプの組織球性疾患の病態を解明しただけでなく、マクロファージの増加や蓄積を引き起こす新たなメカニズムを提唱するものでもあり、SLC29A3異常症以外の組織球症の病態解明にも貢献し得る結果であると考えられる」と、研究グループは述べている。
▼関連リンク
・東京大学医科学研究所 プレスリリース



