肥満とエピジェネティック制御の関連が明らかになりつつある
群馬大学は7月10日、視床下部の摂食中枢で神経伝達物質の輸送を促進し、体重増加を引き起こす神経メカニズムを明らかにしたと発表した。この研究は、同大生体調節研究所の河野大輔助教らの研究グループと、同大医学系研究科、慶應義塾大学、京都大学、大阪大学、岐阜大学との共同研究によるもの。研究成果は、「The EMBO Journal」のオンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
近年、世界の多くの地域で肥満人口が急増しており、その背景には食生活の変化や運動不足といった環境要因の関与が指摘されている。最近の研究から、遺伝子にメチル基などの修飾を加えることで、環境に応じて遺伝子の発現が後天的に調節される仕組み(エピジェネティック制御)が、こうした環境応答の一部を担っていることが明らかになってきた。
脱メチル化酵素FTOはどのようにして体重を調節するのか?
RNAにも「m6A修飾」と呼ばれるメチル化修飾が存在し、RNAのさまざまな側面に影響することが知られている。m6A修飾の脱メチル化酵素の一つである「FTO」というタンパク質は、多くの細胞に存在している。FTOが体重調節に関与することは既に知られていたが、FTOがどのようにして体重を調節しているかは十分には明らかになっていなかった。
脳の視床下部には、食欲や熱産生を調節する「摂食中枢」が存在し、エネルギー摂取と消費のバランスを制御している。摂食中枢の機能異常は、肥満ややせといったエネルギー代謝の異常を引き起こす。そこで今回の研究では、FTOが視床下部の摂食中枢でどのように働き、体重調節に関わるのかを明らかにすることを目的とした。
AgRPニューロンに発現するFTOが体重増加に寄与
まず、視床下部摂食中枢の特定のニューロン群に特異的なFto欠損マウスを作製した。これらのマウスの体重を測定したところ、摂食促進作用を持つAgRPニューロン特異的にFtoを欠損するマウスではコントロールマウスと比較して体重が低下した。そこで、AgRPニューロン特異的Fto過剰発現マウスを作製したところ、このマウスは肥満になった。これらの結果から、AgRPニューロンに発現するFTOが、体重増加に寄与していることが明らかとなった。
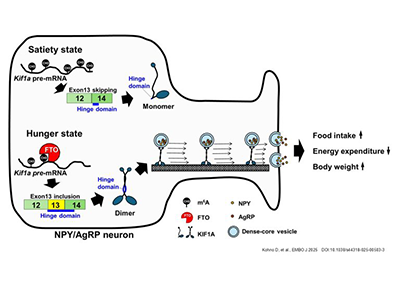
FTOは輸送関連遺伝子Kif1aの選択的スプライシングを調節
次に、分子メカニズムを明らかにするため、AgRPニューロン特異的Fto欠損マウスの弓状核から抽出したRNAを用いて、m6A免疫沈降とRNA-Seq(m6A-Seq)を行った。その結果、FTOは主にPre-mRNAのエクソンやイントロン領域のm6Aを脱メチル化しており、特に選択的スプライシングに関わる遺伝子で脱メチル化が多く見られた。また、キネシンなどの輸送関連遺伝子のmRNAにも多くのm6A脱メチル化が認められた。
さらに、神経細胞特異的Fto欠損マウス(Fto/Tau-Cre)の視床下部組織から抽出したRNAを用いてRNA-Seqを行い、アイソフォーム解析によって網羅的な選択的スプライシングを解析した。その結果、Fto欠損マウスでは、Kif1aのエクソン13含有率が大幅に低下しており、FTOはKif1aのエクソン13を含ませるようにスプライシングを制御していることが示唆された。
FTOはKIF1Aの二量体形成を誘導し、AgRP分泌を促進
KIF1Aは、有芯小胞やシナプス小胞などの軸索輸送に重要な役割を担うタンパク質の一つ。そこで、AgRPニューロン特異的なFto欠損マウスおよび過剰発現マウスの組織学的解析を行ったところ、有芯小胞のマーカーであるSecretogranin IIの免疫陽性密度がFto欠損マウスで低下し、Fto過剰発現マウスで増加することを確認した。さらに、脳スライスからのAgRPの分泌量もFto欠損マウスで低下し、Fto過剰発現マウスで増加していた。
KIF1Aのエクソン13がコードする領域について、AlphaFold2による立体構造予測を行ったところ、エクソン13を含むことでヒンジ領域(KIF1Aの一部分で折れ曲がった構造をしている)が大幅に長くなり、Coiled-coil1aとNeck coilの結合が妨げられることが予測された。
エクソン13の有無による機能の違いを明らかにするため、エクソン13を含む/含まない2種類のリコンビナントKIF1Aタンパク質を合成し、解析を行った。その結果、エクソン13を含むことで、二量体形成が促進され、さらに微小管依存的ATPase活性も増加することが明らかになった。また、微小管上や軸索内でのKIF1Aの移動速度もエクソン13を含むことで向上した。これらの結果から、KIF1Aはエクソン13を含むことにより機能が向上することが示された。
FTO過剰発現マウスの肥満、Kif1aノックダウンで抑制
生理状態との関係を調べたところ、AgRPニューロンでは空腹時にFtoの発現が増加していた。さらに、弓状核から抽出したRNAサンプルの解析では、空腹時にKif1aのエクソン13を含む選択的スプライシングが増えることが確認された。
また、AgRPニューロン特異的にFtoを過剰発現させたマウスで生じる肥満は、AgRPニューロンにおけるKif1aをノックダウンさせることで抑制されることがわかった。これらの結果から、FTOによるKif1a活性化は空腹時に働き、体重調節に関与していることが示唆された。
FTOによる体重調節メカニズム、新たな肥満治療の標的として期待
今回の研究によって、FTOがAgRPニューロンにおいてKif1aの選択的スプライシングを介してKIF1Aの機能を高め、軸索輸送を促進することで体重増加に寄与することが示された。
「本研究により、空腹時に働き体重増加に寄与する脳の新しいメカニズムが明らかになった。今後、このメカニズムを標的とした新しい肥満症治療法の開発が期待される」と、研究グループは述べている。
▼関連リンク
・群馬大学 プレスリリース



