まれに活性化して増殖する休眠状態の神経幹細胞、具体的な仕組みは不明点が多い
理化学研究所(理研)は5月31日、マウスの神経幹細胞において、転写抑制因子Hes1による発現動態依存的な細胞増殖の制御機構を分子レベルで解明したと発表した。この研究は、理研脳神経科学研究センター神経幹細胞研究チームの前田勇樹リサーチアソシエイト、影山龍一郎チームリーダーらの研究グループによるもの。研究成果は、「Cell Reports」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
胎生期に神経幹細胞は活発に増殖し、神経細胞(ニューロン)を大量に産み出すが、大人になると休眠状態になり、増殖せず、神経細胞も産み出さなくなる。ところが、休眠状態になった神経幹細胞がまれに活性化して増殖し、一定数の神経細胞を産み出して、学習・記憶の機能に貢献することがわかっている。しかし、この活性状態と休眠状態を制御する具体的な仕組みには、いまだ不明な点が多く残されている。
Notchシグナルに影響を与えるHes1の発現、神経幹細胞の状態に関与すると示唆
これまでに、Notchシグナルの活性化がこの制御に重要なことが明らかにされてきた。Notch1は増殖する細胞を維持するのに必要であるが、Notch2は神経幹細胞の休眠を誘導する。Notchシグナルのエフェクターである転写抑制因子Hes1は、神経幹細胞の活性状態と休眠状態の両方に必要である。興味深いことに、Hes1の発現動態は活性状態と休眠状態で異なることがわかっている。
増殖中の神経幹細胞ではHes1の発現は振動しているが、休眠状態ではHes1が持続的に高発現している。これらのことより、Hes1の発現動態の違い(発現振動または持続的な高発現)が、神経幹細胞の状態の違い(活性状態または休眠状態)を決める重要な要素になっていると考えられる。しかし、Hes1の発現動態が神経幹細胞の増殖を制御する詳細な仕組みは明らかになっていなかった。
Hes1のKO・OEで神経幹細胞の増殖は減少、発現振動が増殖を誘導すると示唆
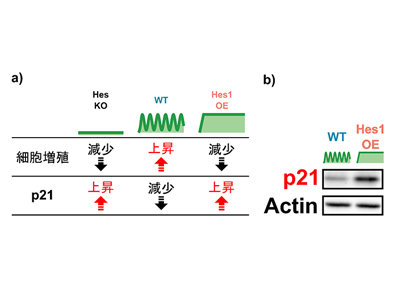
研究グループはまず、神経幹細胞の増殖におけるHes1の必要性を確認するため、マウスを用いて、Hes1遺伝子を欠損させたHes1ノックアウト(KO)神経幹細胞を作製した。実際には、Hes1の機能はHes3、Hes5などのHesファミリー因子群によって補償されるため、Hes1、Hes3、Hes5、Hey1の四つ全てをKOしたHesKO神経幹細胞を作製し、細胞増殖を比較した。その結果、HesKOによって神経幹細胞の増殖が減少することがわかった。
また、Hes1の持続的な高発現(OE)を誘導し、神経幹細胞における影響を調べたところ、Hes1OEは細胞増殖を抑制することがわかった。活発に増殖している野生型(WT)の神経幹細胞では、Hes1の発現が2~3時間周期で振動していることから、このHes1の発現振動が神経幹細胞の増殖を効率よく誘導することが示唆された。
細胞増殖を抑制するp21の発現、Hes1の発現振動時は抑制・持続的高発現時は促進
Hes1が発現動態依存的に神経幹細胞の増殖を制御する仕組みを理解するために、RNA-seq解析を用いて、2組の神経幹細胞(HesKOと野生型、Hes1OEと野生型)における遺伝子発現を網羅的に比較した。その結果、細胞増殖を抑制する機能を持つサイクリン依存性キナーゼ阻害因子(CKI)p21の発現がHesKOとHes1OEでは上昇し、野生型では減少していることがわかった。また、ウェスタンブロッティング解析から、Hes1OEによってp21の発現がタンパク質レベルでも上昇することも確認された。これらの結果は、Hes1の発現が振動しているときはp21の発現が抑制される一方で、Hes1が持続的に高発現しているときはp21の発現が促進されることを示唆している。またHes1OEに加えて、p21の発現をノックダウンによって抑制したところ、Hes1OEによる細胞増殖抑制が改善された。この結果は、Hes1はp21を介して、発現動態依存的に神経幹細胞の増殖を制御することを示唆している。
また、p21の発現がHes1の発現振動によって抑制されるかどうかを調べるため、p21の発現をモニターできるp21プロモーターレポーターを持つ神経幹細胞を用意した。Hes1の発現振動を誘導するため、光に応じて発現のオン・オフが可能なGAVPO/UASシステムをその細胞に導入した。このシステムでは青色光を当てると発現がオンになり、光を遮断すると発現がオフになるため、青色光を特定の頻度で照射することでHes1の発現振動を誘導できる。この神経幹細胞を用いて、Hes1の発現振動を誘導したところ、p21プロモーターの活性が、光刺激のタイミングごとに減少していることがわかった。この結果は、p21の発現がHes1の発現振動によって抑制されることを示唆している。
次に、Hes1OEがp21の発現を活性化するかどうかを調べた。p21プロモーターレポーターを持った神経幹細胞にHes1OEを誘導したところ、最初はp21の発現が減少したが、誘導を開始して約10時間後には、p21の発現が上昇し始め、継続的に上昇し続けることが確認できた。この結果は、Hes1OEが最初p21の発現を抑制するが、ある一定期間、Hes1の発現が続くと今度は反対にp21の発現を活性化することを示唆している。
転写抑制因子Hes1、p21のプロモーターに直接結合し作用
さらに、クロマチン免疫沈降(ChIP)アッセイにより、Hes1が直接p21のプロモーターに結合することがわかった。今までの結果を踏まえると、転写抑制因子Hes1はp21のプロモーターに直接作用して、転写を抑制し、Hes1OEは間接的にp21の発現を活性化すると考えられる。
Hes1OEはDusp7の発現を抑制、Erk1/2のリン酸化上昇しp21発現活性化
次に、Hes1OEが間接的にp21の発現を活性化する仕組みを明らかにするために、野生型とHes1OEの神経幹細胞のシグナル因子の発現を比較したところ、細胞外シグナル制御キナーゼErk1/2のリン酸化がHes1OEの神経幹細胞で上昇していることがわかった。また、Hes1OEを誘導した神経幹細胞に、Erk1/2のリン酸化阻害剤(MEKi)を加えたところ、Hes1OEによって上昇していたp21の発現が抑制された。加えて、Hes1によって抑制されていた細胞増殖もこの阻害剤で回復した。これらの結果は、Erk1/2のリン酸化がHes1OEによるp21の発現上昇に重要であることを示している。
さらに、Hes1OEがErk1/2のリン酸化を誘導する仕組みを調べた。転写抑制因子Hes1は、Erk1/2のリン酸化を抑制する因子の発現を抑制していると仮定した。二重特異性ホスファターゼ(Dusp)は有名なErk1/2リン酸化抑制因子である。野生型とHes1OEの神経幹細胞におけるDuspファミリーの発現を比較したところ、Dusp7の発現が抑制されていることがわかった。また、Hes1OEに加えてDusp7OEも誘導したところ、Hes1によって抑制されていた細胞増殖も回復した。さらに、ChIPアッセイにより、Hes1が直接Dusp7の発現を制御している領域に結合することがわかった。これらの結果は、Hes1OEがDusp7の発現を抑制し、Erk1/2のリン酸化が誘導されることでp21の発現上昇が起きることを示唆している。
以上の結果から、Hes1は直接p21の発現を抑制するが、ある一定期間Hes1の発現が続くとHes1がDusp7の発現を抑制し、Erk1/2のリン酸化が進み、その結果、p21の発現が活性化されることが明らかになった。
アルツハイマー病などの認知力低下の治療、記憶機能の理解の一助になると期待
成体脳における神経幹細胞は、一定の割合で神経細胞を産み出すことで、脳における学習や記憶の機能に貢献している。アルツハイマー病や老化ではこの神経細胞の産出が減少することから、これらの機能が低下する。今回の研究では、Hes1の発現動態(発現振動または持続的な高発現)が神経幹細胞の状態(活性状態または休眠状態)を決める仕組みを明らかにし、成体脳における神経幹細胞の活性状態と休眠状態を制御する機構の理解を深めた。
「本成果は、アルツハイマー病や老化による認知力低下の治療や脳における学習や記憶の機能の理解の一助になると期待できる。また、神経幹細胞だけでなく、骨格筋の衛星細胞などの他の成体幹細胞の活性状態と休眠状態の制御機構の解明にも貢献することが期待できる」と、研究グループは述べている。
▼関連リンク
・理化学研究所 プレスリリース



