膵がんにおけるエピゲノム修飾酵素SETD1Aの異常と、その分子メカニズムは?
東京医科歯科大学は11月10日、膵がんにおいて、ヒストン修飾因子SETD1Aの高発現による下流標的遺伝子RUVBL1の活性化、および両方のタンパク質発現が高いことが予後因子になることを突き止めたと発表した。この研究は、同大大学院医歯学総合研究科 分子腫瘍医学分野の田中真二教授、秋山好光講師、島田周助教、石井武大学院生の研究グループと、同肝胆膵外科学分野の田邉稔教授との共同研究によるもの。研究成果は、「Cancer Science」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
膵がんは世界で罹患数、死亡数いずれも年々増加傾向にあり、いまだに予後不良のがんだ。現在、膵がんの早期発見・予後予測を可能にするバイオマーカーや新規治療法の開発が強く望まれている。膵がんの発生、進展にはゲノム・エピゲノム異常が関わっていることが知られているが、その分子メカニズムにはいまだに不明な点が多く残っている。エピゲノム機構の一つであるヒストン修飾は遺伝子発現制御に関わり、ヒストン修飾異常はがんのみならず生活習慣病などさまざまな疾患の発症に関与している。これまでにヒストンタンパク質のリジン(K)残基の化学修飾の研究が進んでおり、そのメチル化やアセチル化修飾は、遺伝子発現の活性化または不活性化に働くことが知られている。特に、ヒストンH3の4番目、9番目、27番目のリジン残基のメチル化異常は、多くのがんで報告されてきた。
膵がんにおいて、H3K9とH3K27のメチル化に関してはSETDB1、SUV39H1やEZH2などのエピゲノム修飾酵素の異常が報告されてきたが、H3K4については、はっきりわかっていない。H3K4のメチル化修飾は、酵母からヒトまで広く保存されているCOMPASS(Complex of Proteins Associated with Set1)と呼ばれる複合体ファミリーによって触媒され、複数のH3K4メチル化酵素が報告されている。SETドメイン含有タンパク質1A(SETD1A)は、COMPASS複合体構成因子であり、悪性腫瘍でSETD1Aの亢進が報告されてきた。しかし、膵がんにおけるSETD1A異常およびその分子メカニズムは、ほとんどわかっていない。
膵がん105例の半数以上でSETD1A高発現、抑制により膵がん悪性度が低下
研究グループはまず、ヒト膵がんの臨床組織検体105例を用いてSETD1A発現を調べ、51.4%の膵がんで高発現していることを明らかにした。次に、SETD1Aの機能を解明するため、SETD1A発現が強いヒト膵がん細胞を用いて、その発現抑制実験を行った。その結果、SETD1A発現を抑制すると、膵がんの細胞増殖能、遊走能・浸潤能が有意に低下することが判明した。
SETD1AがRUVBL1発現を増強、複数の膵がん細胞で確認
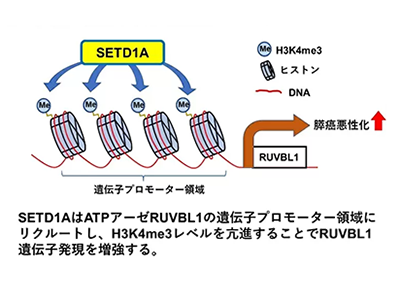
SETD1AはヒストンH3K4をメチル化して下流遺伝子発現を活性化することが知られているが、膵がんでのSETD1A標的遺伝子はいまだに不明だ。研究グループは、複数の膵がん細胞で共通する新規SETD1A標的遺伝子として「RUVBL1」を同定。SETD1AはRUVBL1の遺伝子プロモーター領域にリクルートし、ヒストンH3K4me3レベルを亢進することで、RUVBL1発現を増強することが明らかになった。
SETD1AはRUVBL1を介してがんの悪性度亢進に働く可能性
RUVBL1はDNA依存性ATPアーゼ機能を持ち、遺伝子発現活性化/不活性化、クロマチン再構築、DNA修復、テロメア維持に機能する遺伝子であり、さまざまなタイプの悪性腫瘍で高発現が報告されている。同研究でRUVBL1発現を膵がん細胞で抑えると、細胞増殖能、遊走能・浸潤能が低下し、これらはSETD1A発現を抑えた時と同様の変化を示した。一方、SETD1A発現が弱い膵がん細胞にSETD1Aを高発現させてマウス皮下に移植すると、RUVBL1発現亢進を伴う腫瘍の大きさが増大したという。以上のことから、SETD1AはRUVBL1を介してがんの悪性度亢進に働く可能性が強く示唆された。
ヒト膵がん臨床検体においてもSETD1AとRUVBL1発現は正の相関を示した。SETD1A単独高発現の場合の膵がん患者の生存率は悪い傾向を示すが、両方の発現が強いと生存率は有意に悪いことが明らかになった。
SETD1AとRUVBL1を標的としたバイオマーカー・新規治療法開発に期待
今回の研究により、膵がんの半数以上にSETD1Aの高発現が認められた。また、SETD1AはH3K4メチル化経路を介してRUVBL1の発現を亢進することで膵がんの悪性度を高めていることが、世界で初めて明らかにされた。さらに、臨床的にもSETD1A-RUVBL1高発現は、膵がんの予後予測において独立したバイオマーカーとなることが示唆された。
「現在、SET1ファミリー因子やRUBVL1を標的とする阻害剤が国内外で開発中だ。本研究の成果より、SETD1AとRUVBL1阻害剤の併用療法は、膵がん患者の新規治療法となる可能性を持つと期待できる」と、研究グループは述べている。
▼関連リンク
・東京医科歯科大学 プレスリリース



