ウステキヌマブおよびアダリムマブと比較検討
米アッヴィ社は10月27日、中等症から重症の局面型乾癬の治療薬として開発中のインターロイキン-23(IL-23)阻害薬「risankizumab」について、ウステキヌマブおよびアダリムマブと比較検討した3つの第3相臨床試験の主要な結果を発表した。
Risankizumabは、IL-23のp19サブユニットに結合してIL-23を選択的に阻害するよう設計された開発中の化合物。IL-23は炎症過程に関わる重要なサイトカインで、数多くの慢性免疫関連疾患に関連していると考えられている。現在、乾癬を対象としたrisankizumabの第3相試験のほか、クローン病、関節症性乾癬の治療薬としての開発も進められており、潰瘍性大腸炎を対象とした試験も今後予定されている。
40%の患者が16週時までにPASI100を達成
3つの試験のうち、ultIMMa-1試験とultIMMa-2試験は、risankizumab(150mg)の安全性および有効性をプラセボまたはウステキヌマブ(体重に応じて45または90mg)と比較評価した第3相臨床試験。両試験ともに、16週間投与後の時点で、risankizumab投与を受けた患者の75%がPASI90を達成。また、16週時におけるsPGAスコアの「消失」または「ほぼ消失」(sPGA0/1)の達成率についても、ultIMMa-1試験およびultIMMa-2試験ではそれぞれ、risankizumab群が88%および84%だったのに対し、プラセボ群では8%および5%だった。これらの達成率は、ウステキヌマブ群のsPGA0/1達成率63%(ultIMMa-1試験)および62%(ultIMMa-2試験)と比較しても有意に高かった。
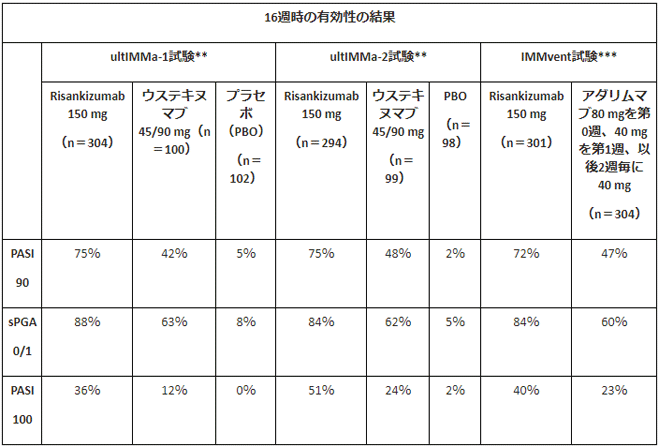
画像はリリースより
IMMvent試験の結果は、16週時点でrisankizumab(150mg)投与を受けた患者の72%がPASI90を達成したのに対し、アダリムマブ(初回に80mg、翌週40mg、以後2週に1回40mg)投与を受けた患者での達成率は47%。sPGAスコアは、risankizumab群の84%が16週までに「消失」または「ほぼ消失」(sPGA0/1)を達成したのに対し、アダリムマブ群の達成率は60%だった。さらに、risankizumab投与を受けた患者の40%が16週時までにPASI100を達したのに対し、アダリムマブ投与を受けた患者での達成率は23%だったという。
▼関連リンク
・アッヴィ合同会社 プレスリリース



