宿主免疫システムはどのように細胞内侵入細菌を認識、オートファジー誘導する?
京都大学は11月19日、ヒトの細胞が人食いバクテリアとして知られるA群レンサ球菌を見分けて分解する新たなメカニズムを明らかにしたと発表した。この研究は、同大医学研究科中川一路教授らの研究グループによるもの。研究成果は、「EMBO Reports」にオンライン掲載されている。
画像はリリースより
オートファジー(自食作用)は、細胞の内容物をオートファゴソームという膜で包み込み、その内容物を分解・再利用するシステムであり、細胞の恒常性維持に重要な役割を担っている。さらに、細胞内に侵入した病原細菌なども選択的に分解する。このオートファジーにより分解される対象物は、ユビキチンと呼ばれるタンパク質が目印として付けられ、そこにオートファジー受容体が結合することで選択的にオートファゴソームに包み込まれる。しかし、宿主免疫システムがどのような仕組みで細胞内侵入細菌を認識し、オートファジーを誘導するのかは不明だった。
FBXO2、GlcNAc発現依存的にA群レンサ球菌結合、ユビキチン化とオートファジー活性促進で生体防御に寄与
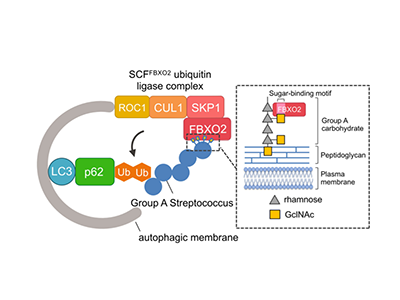
まず、A群レンサ球菌の菌体にある表層糖鎖(Group A Carbohydrate:GAC)について、通常ヒトの細胞質にはないことから、これらの分子が宿主によって認識されているのではないかと考えた。GACを生合成する遺伝子を欠失させた変異株を構築し、これらの変異株の感染時のオートファジーを調査。その結果、GACに含まれるGlcNAc側鎖の生合成に必須な遺伝子欠損変異株でオートファジーの活性が著しく減少していることを見出した。
次に、GlcNAcを認識する宿主のユビキチン結合タンパク質をスクリーニングしたところ、SCFユビキチン結合タンパク質複合体の基質認識タンパク質FBXO2を同定。FBXO2はGlcNAc発現依存的にA群レンサ球菌と直接結合し、ユビキチン化とオートファジー活性を促進し生体防御に寄与することを明らかにした。
新規感染症治療法への応用に期待
オートファジーは細胞内に侵入したさまざまな細菌を分解するとともに、炎症応答や抗原提示等の他の免疫応答とも密接に関連している。このことから、今回の研究成果は、A群レンサ球菌感染症発症機構の解明につながるとともに、今後オートファジーの機序に注目した、細菌そのものへのアプローチ以外の新たな感染症治療法への応用が期待される、と研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る



