「プラセボ鎮痛効果」の神経生物学的な基盤は未解明だった
理化学研究所(理研)は1月29日、薬理作用のない偽薬(プラセボ)の投与により実際に痛みが和らぐ「プラセボ鎮痛効果」の神経生物学的な実態を明らかにしたと発表した。この研究は、理研生命機能科学研究センター生体機能動態イメージング研究チーム(研究当時)の崔翼龍チームリーダー(研究当時、現 分子標的化学研究チーム客員主管研究員)、根山広行研究員(研究当時)、健康・病態科学研究チーム(研究当時)の渡辺恭良チームリーダー(研究当時、現 分子標的化学研究チーム客員主管研究員)、大阪大学医学部附属動物実験施設実験動物学の宮坂佳樹助教らの共同研究グループによるもの。研究成果は、「Science Advances」に掲載されている。
画像はリリースより(詳細は▼関連リンクからご確認ください)
プラセボに対して、効果があると思い込むだけで実際に何らかの治療効果が得られるプラセボ効果は古くから知られ、科学的にも実証されている。しかし、このようなプラセボ効果は、ほぼ全ての医療行為の中に存在しているにもかかわらず、その神経生物学的な実態はいまだに不明であることから、日本でもその医療応用は制限されている。
プラセボ効果の中で最も研究が進んでいるのが「プラセボ鎮痛」だ。近年、ヒトを対象とした機能的核磁気共鳴画像法(fMRI)や陽電子放射断層撮影法(PET)などの非侵襲的脳機能イメージング技術を用いた研究から、プラセボ鎮痛効果によって背外側前頭前皮質、前帯状回、中脳水道周囲灰白質などの脳領域において神経活動が亢進すること、内因性のオピオイドやドーパミン神経系が関わることなどが報告されている。しかし、これらの研究では脳内の大まかな部位は同定できても、「どのような神経細胞」が「どんな機序」で痛みを和らげるか、その詳細な分子神経基盤をヒトで明らかにすることはできていなかった。
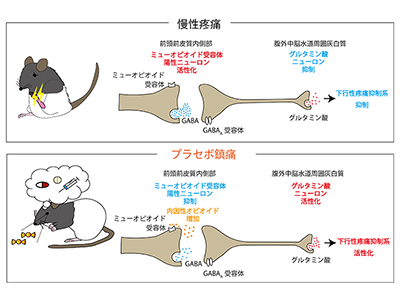
一方、近年の小動物用PETなどのイメージング技術の進歩によって、げっ歯類などの小動物でも臨床データに匹敵する高精度の脳機能画像を得ることが可能になっている。これまで研究グループは、「パブロフの条件付け」を利用してプラセボ鎮痛効果を再現したラットの脳神経活動をPETで解析し、ラットにおいてもヒトの背外側前頭前皮質に相当する前頭前皮質内側部がプラセボ鎮痛効果に関わっていることを発見した。同時に行った行動薬理学的な検討では、前頭前皮質内側部のミューオピオイド受容体(MOR)がプラセボ鎮痛効果に深く関わっていることも突き止めている。ミューオピオイド受容体を発現するニューロン(MOR陽性ニューロン)は、内在性のオピオイドやモルヒネなどの鎮痛薬が受容体に結合すると、その活動が抑制され、痛みを抑える働きがある。しかし、前頭前皮質は脳のさまざまな領域と複雑な神経ネットワークを形成し、情動、認知、動機付けなど多様な高次脳機能に関連しており、この領域に発現するミューオピオイド受容体がどのように痛みを制御しているのかは不明だった。そこで今回、光・化学遺伝学手法を用いて、MOR関連の神経回路を選択的に操作し、プラセボ鎮痛効果の詳細な神経生物学的な基盤の解明を目指した。
mPFCのMOR陽性ニューロン活性化でパブロフの条件付けによるプラセボ鎮痛効果消失
研究グループはまず、脳内のMOR関連の神経回路を特異的に操作するため、先端モデル動物支援プラットフォーム(AdAMS)の支援を得て、脳内の特定領域でのMOR陽性ニューロン特異的に神経活動の操作が可能な遺伝子組換えラットを開発した。このラットを用いて、前頭前皮質内側部MOR陽性ニューロンの活動を選択的に操作し、プラセボ鎮痛効果への影響を調べた。
これまでに研究グループは、後肢への弱い痛み刺激に反応する神経障害性疼痛モデルラットを用いて、数日間の鎮痛剤との条件付けにより、その後プラセボとして投与した生理食塩水でも鎮痛作用が現れることを見出しているが、今回の調査では前頭前皮質内側部(mPFC)のMOR陽性ニューロンを特異的に活性化させると、このような「パブロフの条件付け」によるプラセボ鎮痛効果が消失した。
mPFCからvlPAGに投射ニューロンの神経活動を選択的抑制でプラセボ鎮痛効果が消失
体が受けた痛みの刺激は、感覚神経を伝わって脊髄に入る。脊髄はこの刺激を脳に伝達し、痛みが認識される。これに対し、脳には痛みを弱める仕組みも存在しており、これは脳から脊髄に向けて痛覚情報の伝達を抑制するため下行性疼痛抑制系と呼ばれる。次に、mPFCのMOR陽性ニューロンがどの脳領域を介して下行性疼痛抑制系を活性化するのかを調べた。研究グループはすでに、mPFCと痛みの制御に深く関わっている腹外側中脳水道周囲灰白質(vlPAG)の機能的結合がプラセボ鎮痛効果によって上昇することを明らかにしている。そこで、mPFCからvlPAGに投射する神経回路とプラセボ鎮痛効果の関連について検討した。その結果、mPFCからvlPAGに投射するニューロン(以下、投射ニューロン)の神経活動を選択的に抑制すると、プラセボ鎮痛効果が消失することが判明した。
鎮痛薬の条件付けによって生み出された「期待感」の神経生物学的な実態の解明に成功
最後に、mPFCのMOR陽性ニューロンが、どのような仕組みで投射ニューロンに作用しているかを調べた。複数の実験系を組み合わせた結果から、(1)MOR陽性ニューロンは、投射ニューロンに直接シナプス結合する、(2)活性化したMOR陽性ニューロンは、投射ニューロンを抑制する、(3)MOR陽性ニューロンの選択的な活動抑制は鎮痛作用を示すが投射ニューロンを特異的に除去すると、この鎮痛効果が現れなくなるということが明らかになった。
以上の結果をまとめると、鎮痛薬の条件付けによって生み出された「期待感」の神経生物学的な実態は、(1)プラセボが投与されるとmPFCで内因性オピオイドが増加し、MOR陽性ニューロンの活動が抑制される、(2)vlPAGに投射ニューロンは、普段はMOR陽性ニューロンによる抑制を受けているが、プラセボ投与に伴い脱抑制される、(3)脱抑制された投射ニューロンは下行性疼痛抑制系を活性化し、プラセボ鎮痛効果が現れる。
プラセボ効果による治療効率向上や、心と脳問題の神経科学的な理解に期待
プラセボ効果は、ほぼ全ての医療行為に存在しており、同研究によるプラセボ鎮痛効果の神経生物学的な基盤の解明は、これからの医療現場におけるプラセボ効果の合理的な活用に理論的な根拠を与え、治療効率の上昇だけではなく鎮痛薬の投与量削減による薬物副作用の軽減ならびに耐性・依存の予防などにもつながると考えられる。
昨今、シングルセル解析などのゲノムワイドな解析法の普及によって個々の細胞の遺伝情報が解読され、生命機能や病態に関わるさまざまな遺伝子や機能分子が次々と報告されているが、精神神経活動の分子神経基盤はいまだに不明なところが多く残されている。その主な原因は、分子神経機序の探索に用いる多くの動物モデルが行動学変化の相同性だけに頼っており、どれくらいヒトの精神神経活動を反映しているかは依然として曖昧であることだ。さらにヒトと動物の種差以外にも、脳神経活動を計測する方法論や得られたデータの階層および質が大きく異なることも挙げられる。
「本研究では、小動物脳機能画像解析によってヒトのプラセボ効果といった高度な精神神経活動と一致する脳領域を同定し、さらに光・化学遺伝学手法を駆使し、その詳細な分子神経基盤を明らかにした。これらの研究手法は、プラセボ研究をはじめ、心と脳問題の科学的な理解に有効なアプローチを提供できると期待している」と、研究グループは述べている。
▼関連リンク
・理化学研究所 プレスリリース



