がん細胞のメチル化を標的とする治療、正常細胞との切り分けが課題
大阪大学は6月10日、がん関連線維芽細胞(CAF)特異的にニコチン酸アミドメチル化転移酵素(NNMT)を標的とする核酸医薬を開発し、前臨床試験で抗腫瘍効果を確認したと発表した。この研究は、同大大学院医学系研究科の原知明特任助教、孟思昆特任助教、石井秀始特任教授(疾患データサイエンス学)らの研究グループと、薬学研究科の小比賀聡教授、大澤昂志助教(生物有機化学)、医薬基盤・健康・栄養研究所 人工核酸スクリーニングプロジェクトの笠原勇矢プロジェクトリーダーの共同研究によるもの。研究成果は、「Molecular Therapy – Nucleic Acids」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
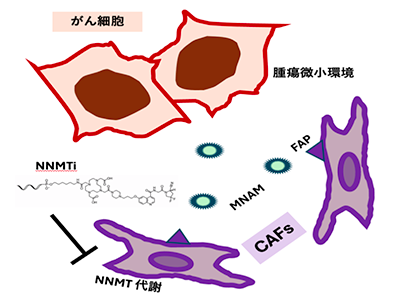
がんの代表的な特徴であるエピジェネティックな機構は、ヒストンやDNAのメチル化により遺伝子転写を制御し、RNAのメチル化により翻訳を調節する。さらに、その他のタンパク質やさまざまな分子のメチル化を通じて、生理機能の活性化に関わることが知られている。これらのメチル化は、単一炭素代謝経路においてSアデノシルメチオニン(SAM)の生合成によって促進されている。腫瘍組織では、このメチル化全体が異常に活性化しており、正常組織にも影響することから、治療を行うためには、がんと正常な細胞を切り分けることが重要になる。
NNMTは、がんで特異性が高い代謝経路の酵素。この酵素の産物であるメチルニコチン酸アミド(MNAM)はCAFから大量に分泌され、周囲の免疫担当細胞におけるがん免疫の疲弊が生じることが知られている。また、NNMTによりメチル化されたMNAMは免疫担当細胞のインターフェロンの生成を阻害するため、抗腫瘍免疫が十分に機能しないという悪循環があった。そのため、腫瘍微小環境を全体として捉えて、ピンポイントで攻撃する新しい分子標的療法の開発が期待されている。
CAFのNNMTをピンポイントで攻撃する核酸医薬を開発
今回の研究では、CAFに高発現するタンパク質(FAP)に着目した。FAPを目印とすることで、CAFで活性化しているNNMTを精密に標的化し、腫瘍全体を見据えながら腫瘍微小環境をピンポイントで改善することを目指した。
研究グループは、FAPを目印にNNMT遺伝子を狙う人工的鋳型(アンチセンス)を用いた核酸医薬をデザインし、配列のスクリーニングおよび核酸の人工合成を行った。この人工的鋳型アンチセンス薬は、前臨床動物試験において腫瘍微小環境を改善し、抗腫瘍効果を発揮することが示された。
細胞内の標的分子を迅速かつ精密に制御する基盤技術として期待
今回の研究では、複合的な細胞間相互作用の中で、ピンポイントで特定の細胞で任意の遺伝子を標的化できる人工鋳型核酸医薬品の精密な送達技術を開発した。これにより、診断や創薬の可能性を広げる技術的な基盤が構築された。
「この技術はこれまで制御不能であった代謝経路の遮断を可能としたことから、がんの『完全治癒』を目指す基盤研究となる」と、研究グループは述べている。
▼関連リンク
・大阪大学 ResOU



