白血病発症・維持に重要なCXCL12と受容体CXCR4、関わる因子の全貌は未解明
京都大学は11月14日、T細胞性急性リンパ性白血病(T-ALL)細胞が骨髄内にとどまり増殖する分子メカニズムとして、遺伝子発現の制御に関わるクロマチンリモデリング因子の一つcBAF複合体が重要な役割を担っていることを明らかにしたと発表した。この研究は、同大医生物学研究所の青木一成助教、遊佐宏介教授らの研究グループによるもの。研究成果は、「Blood」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
急性骨髄性白血病、B細胞性急性リンパ性白血病、T-ALLを含む急性白血病は、悪性度の高い血液のがんである。化学療法と造血幹細胞移植の進歩により、これらの血液腫瘍の予後は飛躍的に改善してきた。しかし、再発・治療抵抗性の急性白血病の予後は依然不良である。従って、これらの白血病に対する新しい治療戦略を見出し、治療法を開発していくことが求められている。そのためには、白血病の細胞増殖の分子機構の詳細な理解が欠かせない。
急性白血病細胞は、正常な造血幹細胞と同様に骨髄に存在し、ニッチと呼ばれる特殊な微小環境によって維持されている。これまでの研究から骨髄内に存在するCXCL12-abundant reticular(CAR)細胞がニッチの中心的構成細胞であることが近年明らかになってきた。これまでに、正常な造血幹細胞や急性白血病細胞は骨髄内でCAR細胞に接着していること、CAR細胞が分泌するCXCL12および血液細胞側の受容体CXCR4が骨髄内での正常造血幹細胞の維持、また白血病の発症および維持に必須であることが明らかとなっている。しかし、この上流あるいは下流でCXCL12-CXCR4軸に関わっている因子の全貌は明らかとなっていない。研究グループは、この分子機序を明らかとすることを突破口として、新しい治療戦略を策定することを目的に研究を行った。
開発した手法で、CXCL12-CXCR4軸とクロマチンリモデリング因子cBAF複合体との関連判明
今回の研究では、T-ALL細胞が骨髄内で増殖すること、これには骨髄内に存在するCAR細胞が分泌する液性因子CXCL12とT-ALL細胞表面に発現するCXCL12の生理的受容体CXCR4が必須であることに着目した。そこで、ゲノムワイドCRIPSRスクリーニングを用いて、CXCL12-CXCR4軸に関係するT-ALL細胞因子を網羅的に同定することから着手した。ゲノムワイドCRIPSRスクリーニングは、研究グループが世界に先駆けて開発したゲノム編集技術を応用した遺伝子探索法で、これまで世界中の研究室において、がん研究を始めとする広い研究分野で用いられている。
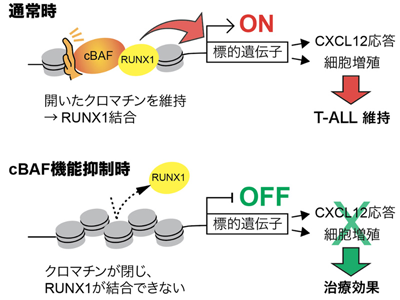
この遺伝子探索を実施した結果、研究グループは、これまでに関連が指摘されていなかったクロマチンリモデリング因子を見出し、詳細な分子機構を解析した。クロマチンリモデリング因子は大別して4種類(SWI/SNF、ISWI、CHD、INO80)知られている。今回見出されたのはこのうちSWI/SNFに関連する複数の遺伝子だった。SWI/SNFは10個以上のタンパク質で構成される巨大複合体であるが、その構成タンパク質の違いにより機能が分かれており、3つの複合体(cBAF、PBAF、ncBAF)に細分化される。遺伝子探索から見出された遺伝子パターンから、これらのうちcBAFがT-ALL細胞のCXCL12との相互作用に関わっていることが強く示唆された。複合体特異的因子を個別に遺伝子破壊した細胞株を作製し、CXCL12に対する応答を調べた結果、cBAF破壊細胞のみで応答が有意に減弱することを確認した。
cBAF複合体、転写因子RUNX1のDNAアクセスを介してCXCR4発現を制御する可能性
次に、cBAF複合体がどのような機序でT-ALL細胞のCXCL12に対する応答に関わっているのか解析を進めた。cBAF複合体をはじめとするクロマチンリモデリング因子は、DNAとヒストンタンパク質の相互作用を調節し、DNA結合タンパク質が標的DNAにアクセスできるよう、開いた状態(オープンクロマチン)とする、またその維持を担っていると考えられている。そこで、cBAF複合体の遺伝子破壊細胞においてATACseq法を用いた解析を実施し、約1万か所でアクセシビリティが低下していることを見出した。さらに、これらの箇所にはRUNX1という転写因子の結合モチーフが特に強く濃縮されていた。RUNX1はT-ALL細胞の増殖に必須の転写因子であることが知られていて、その機能欠損は腫瘍細胞の増殖を減弱させ、2細胞死を惹起する。今回の結果は、cBAF複合体がRUNX1の標的配列への結合に必須であることを示唆している。そこで、cBAF複合体の遺伝子破壊細胞においてRUNX1のゲノムへの結合をChIP-seq法を用いて解析した。結果、先の閉じたクロマチンとなった約1万か所においてRUNX1の結合が有意に低下していることを見出した。この結合低下は遺伝子発現パターンにも影響を及ぼしていて、RNA-seq解析を実施したところRUNX1の標的遺伝子とされる遺伝子群の発現が有意に低下することも確認した。
cBAF破壊細胞の遺伝子発現解析からCXCL12の受容体であるCXCR4の発現が顕著に低下していることを見出したため、CXCR4はRUNX1とcBAF複合体により転写活性化されている可能性が示唆された。そこで、CXCR4遺伝子座を詳細に解析した結果、CXCR4遺伝子のイントロン1の1か所と遺伝子上流の複数箇所において、アクセシビリティが高く、さらにRUNX1が結合している部位があることを発見した。これらの部位においてはヒストンH3の27番目のリジン残基のアセチル化も検出され、エンハンサーとして働いていることが強く示唆された。さらなる解析の結果、これらの部位では、cBAF複合体の機能を阻害することでアクセシビリティの低下、RUNX1の結合減弱やヒストン脱アセチル化が確認でき、エンハンサー機能の喪失がCXCR4の発現低下を誘導、CXCL12に対する応答性を阻害することが明らかとなった。
患者由来T-ALL細胞でcBAF阻害剤の増殖抑制効果を確認
cBAF複合体の機能阻害によりRUNX1のゲノム結合が広範囲に影響を受けることは、cBAF複合体の機能阻害は、RUNX1の機能阻害と同様に、増殖抑制効果があると考えられる。そこで、T-ALL細胞株5つ、また4人の患者由来T-ALL細胞に対しcBAF阻害剤を処理した結果、全ての細胞において増殖抑制効果を確認することができた。増殖に関連するRUNX1標的遺伝子としてCDK6を見出し、その遺伝子座を解析した結果、CXCR4遺伝子座と同様に、CDK6イントロン内にcBAF破壊でアクセシビリティが低下し、かつRUNX1結合が低下する箇所が2つあることを確認した。これらのゲノム部位がCDK6のRUNX1を介したエンハンサーとして機能していることを示している。CDK6の過剰発現はcBAF阻害による増殖抑制効果を部分的に打ち消したことからも、RUNX1がcBAFのクロマチンリモデリング活性によってCDK6発現を誘導し、細胞増殖を促進していることが明らかとなった。
cBAF阻害剤はこれまでに複数開発されている。最後にcBAF阻害がマウスの体内においてヒトT-ALL細胞のCXCR4の発現低下や増殖抑制を誘導できるか、cBAF阻害剤の一つを用いて解析を行った。結果、複数の細胞株、また複数の患者由来T-ALL細胞においてCXCR4の発現低下と細胞増殖の低下を検出した。以上の結果から、cBAFクロマチンリモデリング因子はRUNX1転写因子が誘導する白血病遺伝子発現プログラムに重要な役割を担い、その機能抑制は抗腫瘍効果を発揮することを明らかとした。
cBAF阻害、幅広いがん種の治療法となる可能性
エンハンサー活性に強い依存性を示すがんとして前立腺がんが挙げられ、今回の研究のように、cBAF阻害による必須転写因子のゲノムへの結合阻害が腫瘍細胞の増殖抑制効果を示すことがすでに示されている。cBAFはほぼどの細胞でも発現していることから他のがん種においても同様に機能していると考えられ、さらに解析を進めることでcBAF阻害が幅広いがん種の治療法となる可能性がある。「転写因子やエンハンサーの活性調節によるがん細胞の増殖をコントロールし、より有効な治療法を開発するため、今後も研究を続けていく」と、研究グループは述べている。
▼関連リンク
・京都大学 最新の研究成果を知る



