相同組換え修復経路に異常ない予後不良卵巣がん、ゲノム解析で治療標的は発見できず
理化学研究所(理研)は10月4日、卵巣がんの発がんモデル細胞を用いてマルチオミックス解析を行い、卵巣がんの新しい発がんメカニズムを解明したと発表した。この研究は、理研革新知能統合研究センター目的指向基盤技術研究グループがん探索医療研究チームの町野英徳研究員、浜本隆二チームリーダー、小松正明副チームリーダー、浅田健上級研究員、国立がん研究センター研究所医療AI研究開発分野の金子修三ユニット長、同中央病院婦人腫瘍科の加藤友康科長(研究当時)、病理診断科の吉田裕医員、島根大学医学部産科婦人科学講座の中山健太郎准教授(研究当時)、京哲教授らの研究グループによるもの。研究成果は、「Experimental & Molecular Medicine」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
高異型度漿液性卵巣がん(HGSOC)は世界的に最も頻度の高い婦人科系悪性腫瘍であり、卵巣がんによる死亡者数の70〜80%を占めている。高異型度漿液性卵巣がんのゲノム異常についてはこれまで頻繁に研究されてきており、相同組換え修復経路の分子に機能異常が認められるサブタイプの卵巣がんには、新しい分子標的薬であるPARP阻害剤が有効であることが示され、既に臨床応用が始まっている。一方で、相同組換え修復経路に異常が認められない卵巣がんには、有効な治療法が開発されておらず、いまだ予後不良であることから、個別化医療を推進する上での課題になっている。
このような予後不良なサブタイプの卵巣がんでは、これまで網羅的ゲノム解析によっても有望な治療標的が発見されず、新しい治療法が開発されてこなかったという現状がある。そこで、研究グループはゲノム解析という従来の研究手法の枠組みを超えて、DNAやヒストンの化学修飾によってゲノムの3次元構造や機能を調節するエピゲノムという仕組みの異常に注目し、ビッグデータ解析手法を活用して卵巣がんの新たな治療標的を探索してきた。今回、予後不良な高異型度漿液性卵巣がんに特徴的な新たなエピゲノム異常を解明し、がんエピゲノムを治療標的とする新しい治療法を開発することを目的として研究を開始した。
段階的発がんモデル細胞を樹立、マルチオミックス解析実施
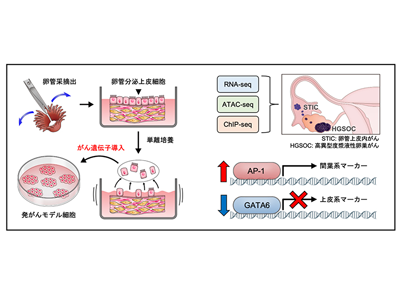
高異型度漿液性卵巣がんの多くは、卵管采(卵管先端の手のような部分)に存在する卵管分泌上皮細胞(HTFSEC)を由来として前がん病変(卵管上皮内がん)が発生し、その後に卵巣表面に播種することで卵巣がんに進展すると考えられている。研究グループは卵管分泌上皮細胞に段階的に遺伝子導入を行い、相同組換え修復経路の分子に異常を認めない、予後不良なサブタイプの高異型度漿液性卵巣がんの段階的な発がんモデル細胞(H、HT、HTK、HTKA、HTKM)を樹立し、網羅的なエピゲノム解析を含むマルチオミックス解析を実施した。
腫瘍形成能の獲得過程でAP-1ファミリー転写因子活性化、GATAファミリー不活性化
RNA-seq解析の結果、がん遺伝子の導入に沿って段階的に発がんモデル細胞の形質が変化していることが確認された。さらに、代表的なエピゲノム解析手法であり、ゲノムのオープンクロマチン領域を評価できるATAC-seq解析では、RNA-seqと比較して、腫瘍形成能を獲得した細胞(HTKA、HTKM)のプロファイルをより明瞭に抽出することができた。これはエピゲノム解析が、正確な細胞情報を取得するために重要であることを示唆している。
ATAC-seqデータを基に、転写因子のDNA結合モチーフの変動を網羅的に評価したところ、腫瘍形成能を獲得する過程でAP-1ファミリーの転写因子が活性化する一方、GATAファミリーの転写因子が不活性化することがわかった。
患者の前がん病変と浸潤がん組織でAP-1ファミリーのJUN発現量上昇
この解析結果を検証するために、卵巣がん患者由来の検体を用いて、卵管組織(正常由来組織)と前がん病変(卵管上皮内がん)組織、浸潤がん(高異型度漿液性卵巣がん)組織の間で、タンパク質発現量を比較した。その結果、正常由来組織と比較して、AP-1ファミリーの転写因子であるJUNの発現量が前がん病変と浸潤がんで上昇し、特に前がん病変では、活性化型のリン酸化JUN(p-JUN)の発現量が上昇していた。これは、高異型度漿液性卵巣がんの発生早期の段階で、JUNの発現上昇と活性化が重要な意義を持つことを示唆している。
また、遺伝子の転写を促進するエンハンサーのマークとして重要なヒストンH3の27番目のリジン(H3K27)のアセチル化(H3K27ac)というヒストン修飾をChIP-seqを用いて評価したところ、卵巣がん細胞株において確かにJUNの転写が活性化されていることが明らかになった。
GATA6-DAB2経路の不活性化、RASシグナル活性化による上皮間葉転換を示唆
一方で、GATAファミリーの転写因子であるGATA6の発現量は、正常由来組織と比較して前がん病変と浸潤がんで低下しており、GATA6によって転写されるDAB2というタンパク質も同様に、発現量が低下していた。GATA6遺伝子とDAB2遺伝子は、H3K27acのヒストン修飾の低下によってタンパク質発現量が低下していることがわかった。DAB2遺伝子は卵巣がんのがん抑制遺伝子であり、がん促進的なRASシグナルを抑制する因子として知られている。このため、GATA6-DAB2経路が不活性化することによってRASシグナルが活性化することが、卵巣がんの発がんに寄与していると考えられた。
RASシグナルの活性化は、上皮細胞が形質転換して浸潤能・転移能を獲得する機構である上皮間葉転換に関わっており、重要な発がんメカニズムの一つである。今回の解析データも、卵巣がんの発がん早期の段階で上皮間葉転換が生じていることを強く示唆していた。
上皮間葉転換に重要なカドヘリンクラスター領域、H3K27acのヒストン修飾低下
そこで、上皮間葉転換に重要なカドヘリン遺伝子を多く含む16番染色体のカドヘリンクラスター領域のH3K27acを確認したところ、高異型度漿液性卵巣がんにおいて、コピー数減少に加えて、広範囲にわたりH3K27acのヒストン修飾が低下していることがわかった。これらの解析結果は、高異型度漿液性卵巣がんの発がん早期に、エピゲノム異常を介したAP-1ファミリーとGATAファミリーの発現異常によって、上皮間葉転換が生じることを示唆している。
トラメチニブ投与によるRASシグナル阻害、エピゲノム異常を修復する可能性
このエピゲノム異常を回復する治療法を探索するために、RASシグナルの阻害剤であるMEK阻害剤(トラメチニブ、Trametinib)を投与した発がんモデル細胞を解析した。すると期待した通り、腫瘍形成能を持つ発がんモデル細胞(HTKM)において、上皮間葉転換に関わるCDH1遺伝子の発現量が回復し、JUN遺伝子に拮抗的に作用するMAF遺伝子に加え、GATA6遺伝子とDAB2遺伝子の発現量が上昇した。
これらの結果は、MEK阻害剤を用いてRASシグナルを抑制することによって、高異型度漿液性卵巣がんのエピゲノム異常を修復することができることを示しており、がんエピゲノムを標的とした新しい治療法の開発に貢献する知見であると考えられる。
エピゲノム異常を標的とした新しい治療薬の開発に期待
今回の研究では、マルチオミックス解析技術により、従来手法では同定することが困難であった卵巣がんのエピゲノム異常と、それに起因する転写因子のDNA結合異常を発見することができた。この成果は、がん研究において、実験室で実施する生化学的手法と、高度な計算機を活用した情報科学技術を融合することによる有機的なデータサイエンスが強力な効果を持つことを示している。
高異型度漿液性卵巣がんは婦人科系悪性腫瘍の中で最も死亡者数の多いがん種であり、予後不良なサブタイプに対する有効な治療法の開発が強く求められている。この研究では、予後不良な卵巣がんの発がんモデル細胞を樹立して、がんエピゲノムを標的としたマルチオミックス解析を行うことにより、高異型度漿液性卵巣がんのエピゲノム異常を介した新しい発がんメカニズムを解明した。
「今後、MEK阻害剤を使用した個別化医療や、エピゲノム異常を標的とした新しい治療薬の開発を通じて、予後不良な高異型度漿液性卵巣がんに対する有効な治療法の開発に結び付くことが期待できる」と、研究グループは述べている。
▼関連リンク
・理化学研究所 プレスリリース



