使用する薬剤も異なる2つの疾患に共通してジスキネジアが起こるメカニズムは?
慶應義塾大学は9月29日、薬剤副作用として知られるジスキネジア(体のくねくね・口のもごもご)が進展していくメカニズムを解明したと発表した。この研究は、同大医学部 先端医科学研究所 脳科学研究部門の阿部欣史助教、田中謙二教授らを含む10施設の共同研究グループによるもの。研究成果は、「Cell Reports Medicine」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
パーキンソン病は、ドパミン神経の脱落により脳内ドパミン濃度が下がることで、次第に身体の動きが鈍くなる無動などの症状が出現する。この症状を緩和させるためにドパミンの前駆物質であるL-DOPAやドパミンアゴニスト(作動薬)を投与してドパミン信号低下を補う。しかし、長期的なL-DOPAの服用は、L-DOPA誘発性ジスキネジア(LID)と呼ばれる自分では止められない体・手足のくねくねした動きを引き起こす。
一方、統合失調症や躁状態の患者は、脳内のドパミン濃度が高まるかドパミン信号が亢進すると推測されており、患者の幻覚妄想や興奮を抑えるためにドパミン受容体2型(D2R)のアンタゴニスト(遮断薬)が処方される。このドパミン遮断薬の長期的な使用により、一部の患者で遅発性ジスキネジア(TD)と呼ばれる自分では止められない口のもごもごした動きが発症する。異なる疾患に異なる薬剤を用いているにも関わらず、なぜ良く似た運動異常(ジスキネジア)が生じるのかは不明だ。そこで研究グループは今回、LIDとTDの発症には共通するメカニズムが存在するのではないかという仮説を立て、メカニズムの解明を試みた。
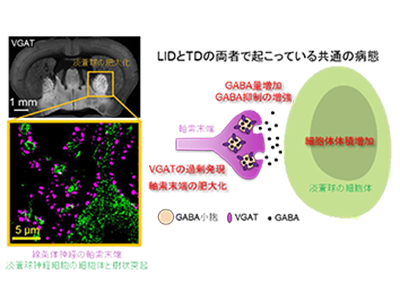
LID/TDモデルマウスに共通する病態は、線条体神経細胞におけるVGATの過剰発現
まず、LIDモデルマウスとTDモデルマウスに共通する脳構造異常を探索した。その結果、いずれの病態においても線条体神経細胞の軸索末端が肥大すること、投射先でシナプス接続する淡蒼球神経細胞体が肥大することを発見した。軸索末端の肥大は、線条体神経細胞における「GABAトランスポーター(vesicular GABA transporter:VGAT)」の発現増加と相関していたという。
さらに、VGAT遺伝子を人為的に過剰発現させるだけで線条体神経細胞の軸索末端が肥大すること、投射先の淡蒼球神経細胞体も肥大することを明らかにした。LIDモデルマウスでは、先行研究において線条体神経細胞と淡蒼球神経細胞間の神経伝達が亢進することがわかっていたが、今回TDモデルマウスにおいても同様の神経伝達亢進が観察された。
VGAT遺伝子過剰発現で、LID/TDモデルマウスのジスキネジアが悪化
次に、VGAT遺伝子発現の多寡で、ジスキネジアの程度が説明できるか検証した。線条体神経細胞にVGAT遺伝子を過剰発現させることで、LIDモデルマウスもTDモデルマウスもジスキネジアが悪化すること、線条体神経細胞のVGAT遺伝子をノックダウンさせることでジスキネジアが軽減することを明らかにした。
線条体神経のVGAT発現増加がジスキネジア発症につながる要因であることが明確になったが、研究グループはさらに、どのような条件が揃うとVGAT発現が増えるのか検討した。パーキンソン病患者がL-DOPAを服用すると、その直後に脳内ドパミン濃度が増加し次第に下がる。このドパミン濃度のアップダウンがジスキネジアを悪化させることが臨床で判明していた。LIDモデルマウスは、パーキンソン病モデルを作製後にL-DOPAを1日1回の経口投与を2週間連続で行うことで作製。研究グループは臨床の知見をヒントに、L-DOPAの徐放剤を1回投与し、2週間薬効を発揮させればパーキンソン病症状は改善する一方でジスキネジアが発症しないと考えた。
結果、予想通りジスキネジアは発症せず、VGATの過剰発現も起こらず、神経肥大も起こらなかった。TD発症のリスクファクターに精神的ストレスと覚せい剤などの違法ドラッグ服用が知られており、いずれも脳内ドパミン濃度を増加させることが知られている。このことから、TDの発症にも脳内ドパミン濃度のアップダウンが必要なのではないかと予想された。
LIDとTDは2つの要因が組み合わさって起こるという「Two-Hit仮説」を提唱
これらの結果をふまえ、研究グループはLIDとTDの発症には2つの要因が組み合わさるという「Two-Hit仮説」をたてた。
具体的には、LIDの場合はパーキンソン病によりドパミン神経が脱落し、ドパミン濃度が低下し、線条体神経細胞のドパミン受容体2型を介する信号(D2R信号)が低下(1st hit)。これに加え、L-DOPAの摂取による脳内ドパミン濃度の周期的な変動が加わる(2nd hit)ことでジスキネジアが発症する。TDの場合は抗精神病薬投与によりD2Rがブロックされる(1st hit)。さらに、日常のさまざまな刺激(ビックリする、食事を美味しいと思うなどの感情変化から精神的ストレスや違法薬物の使用などによるハイテンション)による脳内ドパミン濃度の変動が繰り返し起こって2nd hitとして作用するというもの。
LID/TDともにD2R信号低下+脳内ドパミン濃度変動持続でジスキネジアの病態が発展
最後に、TDにおける2nd hitの位置付けを検討した。抗精神病薬を投与したマウスに、L-DOPAを1日1回、2週間連続で投与し、人為的に脳内ドパミン濃度を変動させた結果、TDの症状が増強され、VGATの過剰発現が誘導され、軸索末端の肥大化が誘導された。次に、抗精神病薬を投与されたマウスに脳内ドパミン濃度の変動を抑える効果を持つ薬剤「バルベナジン」を投与したところ、TDの症状が緩和され、VGATの過剰発現が抑制され、軸索末端の肥大化も抑制された。
以上の結果から、LIDもTDも、線条体神経細胞のD2R信号が低下している状態(1st hit)に加え、脳内ドパミン濃度の変動(2nd hit)が持続することによって、ジスキネジアの病態が発展することが明らかになった。
「two hit仮説」をもとに、精神疾患の発症過程の理解が進むことに期待
今回の研究により、LIDやTDの共通病態として線条体神経VGATの過剰発現が発見されたことで、VGAT分子をターゲットとした新規治療法の開発や診断方法の開発が期待される。
研究グループは「two hit仮説は、素因(1st hit)に環境因(2nd hit)が累積して発症へと展開するモデルを提唱する。素因と環境因の相互作用は統合失調症など多くの精神疾患に通底する発症メカニズムと想定されているが、具体的にどのようにそれぞれの要因が作用しているのか明らかではなかった。今回の発症モデルは、環境因が累積して疾患が発展していく様子を上手く捉えていることから、精神疾患の発症過程の理解が進むことを期待している」と、述べている。
▼関連リンク
・慶應義塾大学 プレスリリース



