敗血症におけるMODSの原因とされる「細胞障害性低酸素」の詳細は不明
九州大学は8月22日、敗血症性心筋症が生じる仕組みを解明し、治療開発に向けた基盤を構築したと発表した。この研究は、同大病院別府病院内科の池田昌隆助教、および医学系学府博士課程の渡邊雅嗣氏(現・九州大学病院麻酔科蘇生科助教)らの研究グループによるもの。研究成果は、「Nature Cardiovascular Research」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
重症感染症では、全身の臓器機能が障害される「MODS」(多臓器不全、Multiple Organ Dysfunction Syndrome)を合併し、敗血症と呼ばれる重篤な病態に至る。敗血症の致死率は30%以上とされ、日本国内では年間約8万1,000人が亡くなっていると推定されている。特に、COVID-19パンデミックにて明らかとなったように、感染症は依然として人類にとっての深刻な脅威であり、克服すべき健康・福祉における喫緊の課題である。
これまで、敗血症におけるMODSの原因は「細胞障害性低酸素(cytopathic hypoxia)」という概念的な現象で説明されてきた。細胞は主にミトコンドリアにおいて酸素を利用してエネルギーを生成するのに対し、細胞障害性低酸素とは、酸素が十分に存在しているにもかかわらず、細胞(あるいはミトコンドリア)が酸素を利用できず、エネルギー不足による細胞機能不全に陥る状態を指す。しかし、この現象の詳細な仕組みは明らかにされていなかった。
敗血症では低酸素非依存的にHIF-1α増、細胞省エネ状態となり臓器の機能障害が起こる
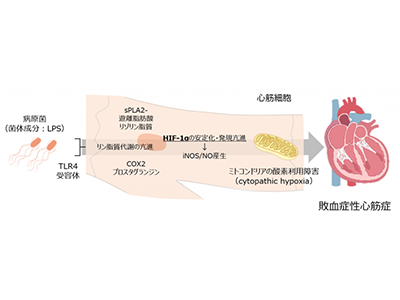
研究グループは今回、本来低酸素環境により発現が亢進する転写因子HIF-1αが、低酸素とは無関係に菌体成分に対する過剰な炎症応答によって発現が亢進することに着目した。
HIF-1αは低酸素環境下において増加し、細胞を「省エネモード」に移行させることで低酸素環境下での細胞生存を可能とする転写因子だが、敗血症では低酸素非依存、つまり低酸素とは無関係の炎症応答によってHIF-1αが増加することで、実際には低酸素環境にないにも関わらず、細胞は省エネモードとなり、細胞および臓器の機能障害を引き起こしていることを明らかにした。
HIF-1αが心筋細胞の酸素利用障害を惹起、リン脂質代謝活性化によりHIF-1α増
さらに、HIF-1αは誘導型NO合成酵素(iNOS)の発現亢進を介した過剰なNOによりミトコンドリアの機能を低下させ、酸素の利用障害を引き起こしていることを明らかにした。また、炎症応答によって誘導されたリン脂質代謝酵素であるCOX2とPLA2G2A(ないしPLA2G5)が、それぞれプロスタグランジンE2およびリゾリン脂質と脂肪酸を生成し、これらが細胞内のHIF-1αを安定化させることでHIF-1αの発現量が亢進していることを明らかにした。
病態解明を基盤とした治療開発による敗血症の克服と、重症感染症の転帰改善に期待
同研究による病態の解明により、HIF-1αそのもののみならず、HIF-1αを安定化させるリン脂質代謝、HIF-1αによりcytopathic hypoxiaを引き起こすiNOSやNOなど、さまざまな治療標的が明らかとなった。これらの病態解明を基盤としたさらなる治療開発により、敗血症の克服と重症感染症の転帰の改善が期待される、と研究グループは述べている。
▼関連リンク
・九州大学 プレスリリース



