根本的な治療が難しいATTR、蓄積したアミロイドの毒性を消す方法は未開発
東京大学は8月7日、難病「トランスサイレチンアミロイドーシス(ATTR)」に対し、新たな治療戦略を打ち出したと発表した。今回の研究は、同大大学院薬学系研究科有機合成化学教室の金井求教授、山根三奈特任助教、梅田大輝大学院生、豊邉萌大学院生、機能病態学教室の富田泰輔教授、堀由起子准教授、熊本大学発生医学研究所の山中邦俊准教授、筑波大学医学医療系/トランスボーダー医学研究センターの広川貴次教授、京都大学化学研究所の梶弘典教授、和歌山県立医科大学の相馬洋平教授、杉村会杉村病院アミロイドーシス診療研究サポートセンターの安東由喜雄総長、熊本大学大学院生命科学研究部の植田光晴教授、富山大学学術研究部薬学・和漢系(薬学)構造生物学研究室の水口峰之教授らの研究グループによるもの。研究成果は、「Journal of the American Chemical Society」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
タンパク質の誤った折りたたみ(ミスフォールディング)とそれによる凝集は、加齢にともなって起こるタンパク質異常の代表的な現象である。特に、それらが不溶性の線維状構造となったものはアミロイドと呼ばれ、高い毒性を有することで知られている。アミロイドは体内で分解されにくく、組織や臓器に沈着することでさまざまな病気を引き起こす原因となる。例として、アルツハイマー病やパーキンソン病、筋萎縮性側索硬化症(ALS)、2型糖尿病、そして全身性アミロイドーシスなど多岐にわたる。世界保健機関(WHO)の予測によれば、こうしたアミロイド疾患は2040年までにがんを超えて死因の第2位に入るとされている。
ATTRアミロイドーシスは、体内にあるトランスサイレチン(TTR)というタンパク質がアミロイドを形成することで発症する難治性疾患である。本来、TTRは甲状腺ホルモンやビタミンAを運ぶ役割を担うタンパク質としてヒトの体に存在しているが、その構造がなんらかの理由で変性(不安定化)すると、毒性のある形に姿を変えてしまうことがある。こうしてできたアミロイドが心臓や腎臓、末梢神経系などに蓄積していくと、全身の臓器を徐々にむしばみ、手足のしびれや筋力の低下、心不全など生活の質を大きく損なう症状が現れるようになる。この変性の仕組みは完全には解明されていないが、遺伝的な要因や加齢が関与するとされている。特に、80歳以上の高齢者の約4人に1人に影響をおよぼすとも言われており、世界的な高齢化の進行とともに、その脅威は増加の一途をたどっているといえる。一方、現在の治療法の多くは「病気の進行を止める」ことが中心で、一度蓄積したアミロイドの毒性を”消す”方法はなかった。そのため、一度発症すると根本的な治療が難しく、有効な治療薬がないまま命を落とす患者も少なくない。
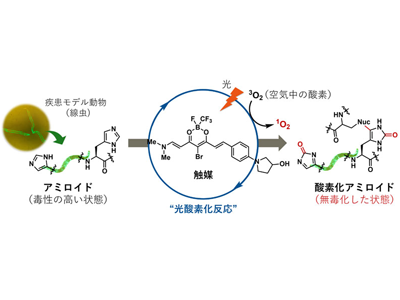
“光”と”触媒”でアミロイド内の特定のアミノ酸に酸素を導入、無毒化する方法を開発
今回、研究グループはこの難題に対し”光”と”触媒”を使った独自のアプローチにより、アミロイドそのものを無毒化するという革新的な戦略で挑んだ。開発された触媒は、小さな分子でありながらアミロイド特有の構造に対して選択的に結合し、生体透過性の高い橙色光を照射することで空気中の酸素を使って、アミロイドの中のヒスチジンやメチオニンというアミノ酸に酸素原子(元素記号:O)を導入する。
この「光酸素化」反応は、正常なタンパク質を傷つけることなく、毒性のアミロイドだけを選択的に毒性の低い状態へと変換することができる。この高い選択性は、治療における副作用のリスクを最小限に抑えるうえで重要な特長である。本反応は、ATTRアミロイドーシス患者から実際に抽出された心臓アミロイド線維に対しても進行することが確認されており、臨床的な有用性も示唆されている。さらに、アミロイドの持つ毒性だけでなく、その凝集性を大幅に低下させることにも成功した。
線虫モデルの運動機能を有意に回復
今回の研究の中でも特に注目されるのが、ヒトのTTRアミロイドを発現させた線虫(C. elegans)を用いた実験である。ATTRアミロイドーシスの病態を再現できるモデル動物は世界的にも非常に限られており、この線虫モデルは現在、本疾患を忠実に模倣できる唯一の実用的なモデル動物とされている。この線虫は、ヒト患者と同様に運動機能の低下(末梢神経系の機能障害による動きの鈍さやしなやかさの喪失)を示すが、光と触媒による治療を行うことで、その運動機能が有意に回復することが今回、明らかとなった。これはつまり「既に体内に蓄積したアミロイドの毒性を除去する」ことによって病態を改善できるという、アミロイド疾患の治療戦略における新たな可能性を示した初の実証例であり、臨床応用に向けた大きな一歩であると言える。
既に蓄積した毒性アミロイドを直接治療、他のアミロイド関連疾患への応用も
従来の治療法は「アミロイドの形成を防ぐ」あるいは「進行を遅らせる」といった予防・緩和的アプローチにとどまっていたのに対し、今回の研究は「既に蓄積してしまった毒性のアミロイドそのものを直接改変・無毒化する」という革新的な視点に基づくものであり、これまで治療が困難だった末期患者や診断・治療が遅れてしまった症例に対しても新たな治療選択肢となり得る可能性を持っている。
今回の研究は「触媒医療(Catalysis Medicine)」という新しい疾患治療概念、すなわち化学触媒を通じて生体内の化学反応ネットワークに能動的に介入した具体的な実証例でもある。「将来的にはアルツハイマー病やパーキンソン病をはじめとした、他のアミロイド関連疾患への応用も期待される」と、研究グループは述べている。
▼関連リンク
・東京大学 プレスリリース



