ウイルスを用いたがん療法、作用機序には不明な点が残る
群馬大学は6月20日、アポリポタンパク質による抗腫瘍効果の機序を解明したと発表した。この研究は、同大未来先端研究機構の二村圭祐教授、太田徳子研究員らの研究グループによるもの。研究成果は、「Journal for ImmunoTherapy of Cancer」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
近年、がん治療法として手術、抗がん剤、放射線に加え、新しい選択肢として「免疫療法」が注目されている。がん免疫療法は、患者自身の免疫の力を利用してがん細胞と戦う、これまでとは異なるアプローチだ。特に、「免疫チェックポイント阻害薬」の登場により、治療が難しかった難治性がんに対しても効果が現れるケースが報告され、世界的に注目が集まっている。しかし、適応できるがんの種類が限られるなど、多くの課題がある。
最近では、さまざまなウイルスが抗腫瘍効果を持つことが明らかになり、複数の改変ウイルスが、がんの治療の研究や医療用に開発・販売されている。ウイルス療法の基本的なコンセプトは、1)感染した腫瘍細胞内でのウイルス増殖による細胞死の誘導、2)死細胞断片とウイルスの放出による免疫活性化である。一方で、増殖しないウイルスも腫瘍増殖を抑制する効果があることが知られていたが、そのメカニズムはほとんど明らかになっていなかった。
HVJ-Eの抗腫瘍効果、どのようなメカニズムで誘導されるのか?
UV照射によりRNAゲノムを切断し、増殖能を失わせたセンダイウイルスエンベロープ(HVJ-E)は、大阪大学の金田安史名誉教授によって開発され、HVJ-Eの腫瘍内投与により腫瘍増殖を抑制できる抗腫瘍効果があることがわかっていた。実際に、悪性黒色腫、去勢抵抗性前立腺がん、悪性胸膜中皮腫の患者に腫瘍内投与したところ、腫瘍増殖を抑制することが臨床試験で明らかになっている。
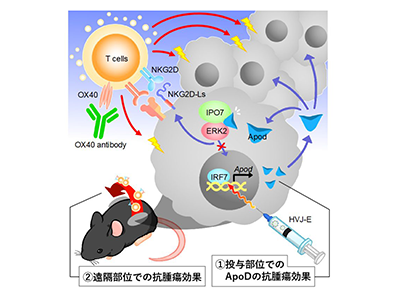
これまでに研究グループは、HVJ-EとT細胞活性化抗体であるOX40アゴニスト抗体(OX40抗体)を組み合わせて腫瘍内投与すると、標的腫瘍でT細胞が増幅・活性化され、このT細胞が遠隔部位にある非標的腫瘍へ移動することで、全身性に抗腫瘍効果を誘導できることを見出している。HVJ-Eの抗腫瘍効果のメカニズムとして、細胞質でウイルスRNAを感知するタンパク質RIG-Iなどが関与すると考えられている。しかし、実際の腫瘍でどのようにしてHVJ-Eが抗腫瘍効果を誘導するのかほとんど明らかになっていなかった。
HVJ-Eによる抗腫瘍効果、免疫細胞の寄与は少ない
今回の研究では、まず、免疫細胞(T細胞、B細胞、NK細胞)を持たない免疫不全マウスを用いて、HVJ-Eの抗腫瘍効果に免疫細胞が必須かどうかを検討した。免疫不全マウスにがんを形成させ、HVJ-Eをがん内投与したところ、野生型マウスと同様にがんの増殖を抑制できたことから、HVJ-Eによる投与部位での抗腫瘍効果に免疫細胞の関与は少ないことが明らかになった。
HVJ-Eの抗腫瘍効果に「IRF7」「ApoD」が関わることを発見
そこで、HVJ-Eは、がん細胞の遺伝子発現を変化させることで抗腫瘍効果を誘導しているのではないかと仮説を立てた。HVJ-Eを投与したメラノーマ腫瘍(皮膚がんの一種)をマウスから回収し、がん細胞の遺伝子発現を調べたところ、27個の遺伝子が顕著に発現増加することを見出した。
これらの中にHVJ-Eによる抗腫瘍効果に関与する遺伝子があると考え、遺伝子改変ツールCRISPR/Cas9を用いて遺伝子欠損(ノックアウト)させた27種のがん細胞を作製した。27個の候補のうち、多くの遺伝子の発現を制御する転写因子「IRF7」をノックアウトしたがん細胞では、HVJ-Eの抗腫瘍効果が減弱した。一方、細胞内でウイルスRNAを感知するタンパク質であるRIG-Iや、ウイルス感染防御に働く1型インターフェロン受容体などの遺伝子をノックアウトしてもHVJ-Eの抗腫瘍効果にはほとんど影響が見られなかった。
また、27個の中には、脂質の運搬に関与する「アポリポタンパク質D(ApoD)」が含まれていた。「ApoD」をノックアウトしたところ、顕著にHVJ-Eによる抗腫瘍効果が減弱した。これらの結果から、HVJ-Eの抗腫瘍効果にはIRF7とApoDが関与することが明らかになった。
HVJ-EはIRF7を介して抗腫瘍効果を発揮する
次に、HVJ-Eの抗腫瘍効果にIRF7が必須なのであれば、IRF7を発現させることのみで、抗腫瘍効果が誘導されるのではないかと仮説を立てた。特殊な薬剤によってIRF7を発現させるメラノーマ細胞を作製したところ、腫瘍形成後にIRF7を発現させると腫瘍増殖が抑制された。
ApoDの抗腫瘍効果を確認、ERK2核移行阻害によりがん細胞に細胞死を誘導
さらに、IRF7は他の遺伝子発現を調節する転写因子であることから、その標的となる遺伝子を探索したところ、ApoDが標的遺伝子であることがわかった。そこで、ApoDを同様に薬剤で発現させたところ、ApoDでも腫瘍増殖が抑制された。
ApoDによるがん細胞の増殖抑制メカニズムを探索するため、細胞の全遺伝子を対象にApoDの抗腫瘍効果への影響を検討した。その結果、がん細胞の増殖などを司るシグナル伝達因子ERK2がApoDの抗腫瘍効果に関与することを見出した。
そのメカニズムとして、ApoDがERK2の核移行を阻害し、がん細胞の細胞死を誘導することが明らかになった。さらに実験を進めると、ERK2を核へ運ぶタンパク質Importin7(IPO7)とERK2の複合体とApoDが結合し、細胞質にとどまることがわかった。これにより、ApoD発現ががん細胞の増殖を抑制させ、投与部位において、抗腫瘍効果を示すと考えられた。
ApoDタンパク質+T細胞活性化抗体により遠隔部位で抗腫瘍免疫の誘導に成功
ERK2の核移行阻害によって、T細胞と相互作用するNKG2Dリガンドの発現が増加することも確認されたため、ApoDとOX40抗体の組み合わせによって抗腫瘍免疫が活性化し、全身性の抗腫瘍効果が誘導できるか検証した。
その結果、HVJ-E+OX40抗体と同様に、ApoDタンパク質+OX40抗体でも抗腫瘍免疫を誘導することができた。このことは、ApoDとT細胞の活性化だけでも、遠隔部位での抗腫瘍効果が得られることを意味している。これらの結果から、ApoDがHVJ-Eによる局所および全身性の抗腫瘍効果の本体であることが示された。
新しい抗腫瘍免疫誘導法開発の基盤となる発見
今回の研究成果から、個別化することなくApoDとOX40抗体の組み合わせによって、がん組織内に侵入するT細胞を増幅・活性化し、遠隔部位の非標的がんにも抗腫瘍効果を誘導できることがわかった。
「近年、発達してきたがん免疫療法や細胞療法では、がんの遺伝子変異によって生じる抗原(ネオアンチゲン)の同定や、CAR-T細胞における細胞の遺伝子操作などの繊細で高度な技術が行われている。本研究の方法は、体内で免疫細胞を活性化できるため、従来のような制限がなく、有効な免疫治療法の開発につながると期待される。一方で、タンパク質の投与では、がん組織内での濃度を安定的に高められないので、高効率に抗腫瘍免疫を活性化するためには、さらなる改善が必要だ」と、研究グループは述べている。
▼関連リンク
・群馬大学 プレスリリース



