先天性難聴、原因遺伝子は150種類以上で蝸牛研究にも課題残る
北里大学は5月27日、遺伝性難聴DFNA78のマウスモデルとして、原因遺伝子SLC12A2に実際の患者と同等の遺伝子変異を導入した難聴モデルマウスの作出に成功したと発表した。今回の研究は、同大医学部分子遺伝学の務台英樹講師、藤岡正人教授、国立病院機構東京医療センター臨床研究センターの松永達雄部長、慶應義塾大学医学部共同利用研究室(細胞組織学)の黒田有希子講師、松尾光一教授、東京大学大学院農学生命科学研究科の市川紗希学部生(現:同薬学系研究科修士)、片岡直行准教授、田中智教授らの研究グループによるもの。研究成果は、「Scientific Reports」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
先天性難聴は、新生児500~1,000人に1人の割合で起こり、その60~70%は体の設計図である遺伝子の異常が原因である。難聴を引き起こす遺伝子はこれまでに150種類以上見つかっていて、原因によって難聴の重さや進行の程度、ほかの体の部分への影響が変わる。そのため、どの遺伝子に異常があるのかを特定し、体の内部でどのような障害が起きているのか、患者の症状が将来どのように変化するのか(あるいはしないのか)を知ることが、治療や支援のために非常に重要である。
音を感じる器官である蝸牛は頭の側頭骨という硬い骨に囲まれた小さな器官であるため外部からの観察が難しく、また再生しないため取り出して調べることもできない。そこで、患者と同じ原因で難聴になる動物(主にマウス)を作り、その動物を使って病気の仕組みを研究する方法がとられている。これによって、病気の理解と治療法の開発が進む。
遺伝性難聴DFNA78の原因となるSLC12A2、完全欠損では病態が異なる
研究グループは、日本の4つの家族の難聴患者からSLC12A2という遺伝子に異常があることを見つけ、2020年に発表した。SLC12A2遺伝子の異常はDFNA78と呼ばれる遺伝性難聴を引き起こし、患者は生まれつき高度から重度の難聴になる。さらに、見つかったすべての異常がエクソン21という遺伝子の特定の部位に集中しており、この異常によってSLC12A2タンパク質がそのイオン(Na+, K+, そしてCl–)の通り道としての働きを失うことも明らかにしている。しかしそれがどのように難聴という症状につながるのか、詳しい仕組みはまだ不明だった。
SLC12A2タンパク質は体中のほとんど全ての細胞の細胞膜上に存在しており、細胞の浸透圧を調整する役割を持っている。蝸牛では「血管条」という内リンパを作る組織に特に多く存在する。過去の研究で、Slc12a2が完全に欠損したマウスは内リンパを作れず難聴になることがわかっている。
一方で、SLC12A2は「Kilquist症候群」という脳や消化器にも問題がでる病気の原因にもなる。この場合SLC12A2タンパク質が完全になくなるのが原因である。DFNA78の患者ではSLC12A2が完全になくなるのではなく、特定の部分(エクソン21)だけに異常がある。このため、これまでの「Slc12a2が完全にないマウス」を使った研究ではDFNA78と同じ症状が再現できているか保証がない。そこで研究グループは、DFNA78と同様にSlc12a2のエクソン21に異常をもつマウスを新たに作り、病気の仕組みを詳しく調べることにした。
患者と同じ遺伝子変異持つマウスの1系統で難聴を確認、性差も判明
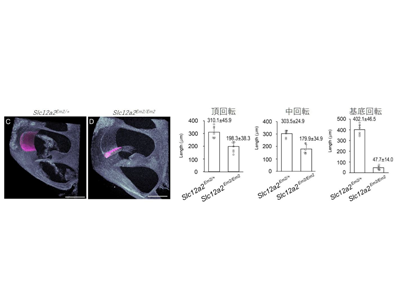
今回の研究ではDFNA78の病態解析と今後の治療法開発研究のモデルとして、患者で見つかった、SLC12A2のエクソン21のスプライスバリアントと同様の遺伝子変異を導入した2系統のマウス(Slc12a2Em1, Slc12a2Em2)をゲノム編集技術により作出した。Slc12a2Em2マウスは変異ホモ(Slc12a2Em2/Em2)で音刺激に対する反応が消失した。変異ヘテロ(Slc12a2Em2/+)でも聴力の低下が見られたが、不思議なことにこの効果はメスでのみ認められた。この性差の説明は今後の課題である。
変異ホモの内耳蝸牛組織で内リンパ産生不全や血管条の顕著な萎縮など観察
変異ホモの内耳蝸牛組織においては、生後1日での内リンパ産生不全、音が聞こえ始める生後12日以降での血管条の顕著な萎縮と細胞サイズの縮小が観察された。
さらに、微細な形態変化の評価のためサブミクロンX線CTシステム(nano3DX、リガク社)を用いて非破壊的な蝸牛内部構造を観察し、血管条萎縮の計測にも成功している。蝸牛血管条形態観察に本手法を応用したのは世界初である。
続いて、蝸牛組織に対する網羅的遺伝子発現解析(Bulk RNA-seq)により、変異ホモマウス蝸牛では細胞間接着分子群、中でも密着結合をつかさどるCldn9の発現量が4週齢で増加していることを見出した。
Slc12a2変異、エクソン21消失で内リンパ減少し難聴に至る機構判明
Slc12a2Em2マウスが示す難聴の病態は、Slc12a2のエクソン21領域の消失による機能不全のため蝸牛内リンパ産生量が減少し、そして浸透圧変化に対応した細胞萎縮のため細胞間隙からの内リンパの「漏れ」により、内リンパ組成が乱れ感覚細胞の音刺激に対する反応が消失した結果と示唆される。また、Cldn9タンパク質の上昇は、内リンパの「漏れ」を防ぐための生理的反応と考えられた。
もう1系統のSlc12a2Em1マウスは意外なことに、Slc12a2Em2マウスとは異なり変異ホモでも聴力正常で、蝸牛形態も正常だった。Slc12a2Em1マウス蝸牛では転写産物中に9塩基(3アミノ酸)短縮したエクソン21を持つものが存在していることが明らかとなり、これがイオン輸送能を保持しているためではないかと考えられた。エクソン21領域の塩基配列は動物種間で非常に高い保存性を示すが、エクソン21の5’末端にはヒトとマウス間にわずか1塩基の相違があり、これがスプライシングに異なる影響を与えていることが細胞実験で確認された。つまりSlc12a2Em1マウスが聴力正常である理由は、動物種によりSLC12A2のエクソン21のスプライシング機構が異なることが原因とわかった。
確立したマウス、遺伝子治療の評価などの活用にも期待
今回の研究で確立したSlc12a2Em2マウスは、DFNA78の病態解明にとどまらず、新しい治療法の開発に向けた前臨床研究にも活用できる。特に、遺伝子治療や分子標的治療の評価において重要な役割を果たすと期待される。「また今後の基礎医学研究の進展により、SLC12A2の全塩基配列が決定されて30年たつにも関わらず、依然として機能未解明のエクソン21領域がもつ役割や、内リンパの電解質バランスの維持機構についての理解が深まると考えられる」と、研究グループは述べている。
▼関連リンク
・北里大学 プレスリリース



