心臓における分岐鎖アミノ酸代謝の変化と心不全発症メカニズムは?
神戸大学は5月7日、糖尿病による心臓病「糖尿病性心筋症」の発症に、アミノ酸の代謝が関与していることを明らかにしたと発表した。この研究は、同大大学院医学研究科立証検査医学分野の長尾学特命准教授、篠原正和教授(分子疫学分野併任)、静岡県立大学大学院薬食生命科学総合学府栄養生理学研究室の細岡哲也准教授らの研究グループによるもの。研究成果は、「Cardiovascular Diabetology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
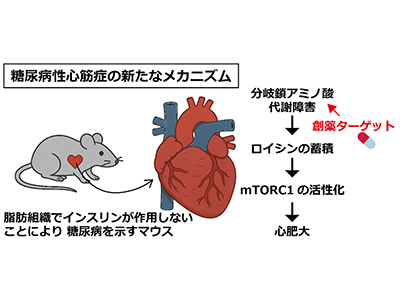
糖尿病は単なる血糖異常だけでなく、心不全のリスクを著しく高めることが知られている。特に糖尿病性心筋症は、冠動脈疾患や高血圧といった他の心疾患を伴わずに心不全を引き起こす病態であり、日本を含む先進国では、高齢化や糖尿病患者の増加とともに、今後ますますの増加が懸念されている。一方、近年の研究により心不全患者では心筋での「分岐鎖アミノ酸」代謝が障害され、それが異常に蓄積することが示唆されてきた。
分岐鎖アミノ酸の蓄積は、心臓の代謝バランスを崩し、心機能低下や心肥大を引き起こす可能性が指摘されている。しかし、糖尿病性心筋症における心臓の分岐鎖アミノ酸代謝異常の実態や、それが病態にどう関与するかについては、これまで明確な証拠が得られていなかった。
そこで研究グループは今回、脂肪細胞のインスリンシグナル異常により自然に糖尿病性心筋症様の変化を起こす新たなマウスモデルを用いて、心臓における分岐鎖アミノ酸代謝の変化と心不全発症メカニズムを解明することを目指した。
分岐鎖アミノ酸代謝障害<mTORC1活性化<心肥大という新メカニズムをマウスで実証
研究では、インスリンの働きを伝えるタンパク質PDK1を脂肪細胞で欠失させることにより、脂肪組織でインスリンが作用しないマウスを用いて解析を行った。このマウスでは高血糖に加えて、特別な食餌や外的心臓負荷を与えなくても自然に心肥大が発症し、心臓におけるインスリン抵抗性と分岐鎖アミノ酸代謝の障害が確認された。特に、分岐鎖アミノ酸の一種であるロイシンが心筋内に蓄積し、細胞成長を制御するmTORC1シグナル経路を異常に活性化させることで、心肥大を引き起こすことが明らかになった。
さらに、分岐鎖アミノ酸の代謝を促進する薬剤を投与したところ、心臓組織のロイシン濃度が低下し、mTORC1活性と心肥大がともに改善することが確認された。これらの結果により、糖尿病性心筋症における新たな発症メカニズムとして「分岐鎖アミノ酸代謝障害-mTORC1活性化-心肥大」という一連の流れが実証された。
糖尿病患者の生命予後や生活の質向上への貢献に期待
今回の研究により、糖尿病性心筋症における心不全発症メカニズムに「分岐鎖アミノ酸代謝異常」という新たな視点が加わった。今後は、分岐鎖アミノ酸代謝やmTORC1シグナル経路を標的とした治療法の開発が期待され、特に既存の糖尿病治療薬とは異なる作用機序をもつ新たな心不全治療薬の創出につながる可能性がある。
「PDK1を脂肪細胞で欠失させたマウスは、糖尿病に伴う心臓病の病態解析や創薬研究における有用な前臨床モデルとして活用されることが期待される。これにより、糖尿病患者の生命予後や生活の質の向上に貢献することが期待される」と、研究グループは述べている。
▼関連リンク
・神戸大学 プレスリリース



