がん細胞・腫瘍血管・免疫系を標的にしたがん薬物治療、その多くで薬剤耐性に課題
金沢大学は4月28日、ナノ粒子を用いて腫瘍内の血管を破壊する新しいがん治療法の開発に成功したと発表した。この研究は、同大医薬保健研究域薬学系の中村孝司教授、北海道大学大学院薬学研究院の原島秀吉教授、北海道大学大学院歯学研究院の樋田京子教授らの研究グループによるもの。研究成果は、「Biomaterials」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
現在のがんに対する薬物治療では、がん細胞を標的にした戦略、腫瘍血管を標的にした戦略、免疫系を標的にした戦略が主に用いられている。最近の治療法の進歩により、患者の予後は大きく改善されたが、がんは依然として深刻な疾患であり、特に薬剤耐性獲得が大きな問題となっている。がん細胞を標的とする薬剤には、化学療法薬や分子標的薬があり、がん細胞の変異が薬剤耐性につながる。腫瘍血管を標的とする薬剤は、通常、血管新生阻害薬であり、血管内皮増殖因子を阻害する薬剤が含まれる。
この腫瘍血管を標的とした戦略は、薬剤をがん細胞に直接送達するよりも効果的であり、血管新生を阻害して血管を正常化することでがんの増殖を遅らせる。ただし、腫瘍内皮細胞(tumor endothelial cell: TEC)の不均一性や、血小板由来増殖因子、アンジオポエチン、線維芽細胞増殖因子などの他の血管新生メカニズムの活性化は、耐性につながる可能性がある。
さらに、免疫チェックポイント阻害剤などの免疫系を標的とした薬剤は、その有効性が、標的チェックポイント分子の発現レベル、T細胞からの逃避機構の獲得、および他の免疫抑制機構の有無、すなわち腫瘍微小環境の免疫状態に左右される。従って、新しいメカニズムの薬剤や複数の薬剤を戦略的に組み合わせることによって、この耐性を克服する治療法を開発する必要がある。
TECに到達しやすいなどの利点があるVDA、選択性や新規メカニズムの薬剤が望まれる
血管破壊剤(vascular disrupting agent:VDA)は、腫瘍血管を直接標的としてTECを傷害し、腫瘍血管の崩壊と結果として広範囲のがん細胞の壊死(ネクローシス)を引き起こす薬剤である。VDAは、TECに到達しやすい、がん細胞の特性や腫瘍微小環境の免疫状態に左右されない、耐性リスクが低いなど、他の薬物療法と比較して利点がある。しかしながら、現在開発中の薬剤は、低分子化合物であるため、全身血管への影響による心毒性などの副作用が実用化の妨げとなっている。さらに、がん細胞の壊死の結果として生じる強い低酸素状態は、低酸素誘導因子を介した血管新生を活性化し、腫瘍の再増殖につながる。そのため、腫瘍血管選択性を持つ薬剤や、血管を破壊するメカニズムが異なる薬剤の開発が望まれている。
TEC標的LNP・自然免疫活性化LNPを開発、併用で腫瘍モデルの腫瘍血管を選択的に破壊
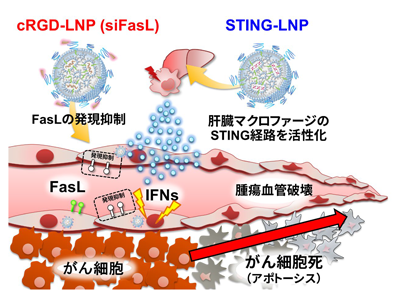
研究グループは、TECを標的とした脂質ナノ粒子(lipid nanoparticle:LNP)と自然免疫を活性化するLNPを併用することで、腫瘍血管を選択的に破壊できることを見出した。TECを標的としたLNPは、Fasリガンド(FasL)の発現を抑制するsmall interfering RNA(siRNA)を封入し、LNP表面にTEC標的化リガンドとして、環状RGDペプチド(cRGD)が修飾されている(以下、cRGD-LNP (siFasL)と表記)。また、自然免疫を活性化するLNPは、自然免疫応答経路であるstimulator of interferongenes(STING)経路を活性化するcyclic di-GMPをアジュバントとして封入している(以下、STING-LNPと表記)。
マウス大腸がん細胞CT26を皮下移植した腫瘍モデルに対し、cRGD-LNP (siFasL)とSTING-LNPの併用療法を行った結果、併用療法を行った群においてのみ、緑色蛍光で染色した腫瘍血管が減少していた。一方で、コントロール群や単剤投与群での腫瘍血管の減少は認められなかった。この血管破壊は、腫瘍組織に選択的に誘導することができる。続いて、同CT26腫瘍モデルを用いて抗腫瘍活性を評価した。
併用療法は既存VDAより顕著に高効果、ヒトがん細胞移植モデルでも治療効果を確認
現在臨床試験段階にある低分子化合物のVDAであるcombretastatin-A4-phosphate(CAP4)とplinabulinとの比較において、この併用療法はこれらの血管破壊剤よりも顕著に強い治療効果を示した。また、この併用療法は、現在臨床で使用されている血管新生阻害剤と比較しても顕著に治療効果を示した。他にも、免疫チェックポイント阻害剤に耐性を示すマウス腫瘍モデルに対しても、この併用療法は強い治療効果を示すことが明らかになった。
さらに、複数のヒトがん細胞株をヌードマウスに皮下移植した腫瘍モデルを用いた抗腫瘍活性の検討も実施した。その結果、ヒト肺がん細胞A549やヒト膵がん細胞BxPC-3を移植した腫瘍に対して、顕著な治療効果を示すことが明らかになった。これらのヒト腫瘍モデルにおいても、併用療法時に血管破壊が誘導されていることが明らかになっており、ヒトでも同じメカニズムを介したがん治療効果を示す可能性が示唆されている。
低酸素状態となるネクローシス誘導せず血管破壊、従来VDAの問題回避できる可能性
薬効メカニズムの検討では、各種自然免疫応答の阻害抗体を用いた実験から、I型インターフェロンのシグナル経路が併用療法の抗腫瘍活性に寄与していること、RNAシークエンス解析の結果から、コラーゲン形成の阻害が関与している可能性が明らかになり、新しいメカニズムによる血管破壊であることが強く示唆されている。また、低分子化合物のVDAは腫瘍組織の急速なネクローシスを引き起こし、低酸素状態によるがん細胞の再増殖が懸念されているが、この併用療法は腫瘍組織のネクローシスは誘導せず、アポトーシスによるがん細胞死を誘導することが明らかになった。このことから、従来のVDAの問題点を回避できる可能性が示唆される。
今回の研究では、新しいメカニズムによる腫瘍血管選択的な破壊を誘導することができるがん治療法を見出した。この研究成果は、新しいタイプのがん治療法の開発に貢献できると期待される。「今後は、詳細な薬効メカニズムの解明を進め、創薬シーズとしての有用性を検討していく予定」と、研究グループは述べている。
▼関連リンク
・金沢大学 News Release



