神経変性疾患では細胞に不溶性タンパク質が蓄積する
沖縄科学技術大学院大学(OIST)は4月24日、アデノシン三リン酸(ATP)がパーキンソン病や筋萎縮性側索硬化症(ALS)に関連するタンパク質の異常凝集を防ぐことを明らかにしたと発表した。この研究は、同大分子神経科学ユニット/細胞分子シナプス機能ユニットのローラン・ギヨー博士らの研究チームによるもの。研究成果は、「Science Advances」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
アルツハイマー病、パーキンソン病、筋萎縮性側索硬化症(ALS)などの神経変性疾患は、神経系の機能が徐々に損なわれる疾患。世界中で毎年、数百万人が罹患している。これらの疾患は、遺伝、生活習慣、併発感染症などさまざまな要因が複雑に絡み合うため、診断から治療に至るまで、予防や効果的な治療が非常に難しいことで知られている。
多くの神経変性疾患に共通する病理的特徴の一つは、「液-液相分離(細胞内で液体状の区画が形成されるプロセス)」により、膜を持たない不溶性タンパク質の凝集体が形成・蓄積されることだ。これらのタンパク質凝集体は症状の進行とともに、細胞内だけでなく細胞の外にも蓄積する可能性がある。例えば、アルツハイマー病の後期では、タンパク質凝集体が神経原線維変化として現れることがある。
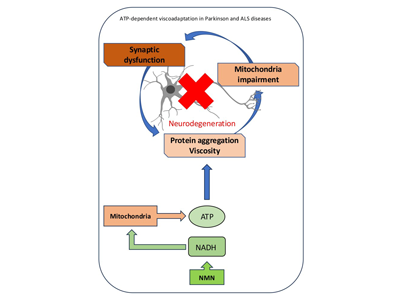
ATPにはタンパク質の溶解性を高める働きがある
最近の研究では、ATPがin vitroでタンパク質の可溶化や酵母細胞での細胞質の粘性調整に直接関与し、重要な「ハイドロトロープ剤」として作用する可能性が示されている。ハイドロトロープ剤とは、さまざまなタンパク質を含むため水に溶けにくい物質の溶解度を高める化合物のこと。
通常、哺乳類の細胞では平均して4~8mMという高い濃度のATPが存在している。細胞内の全てのエネルギープロセスに必要なATPの総濃度は、数百μMと、1桁低い値であることを考えると、これは驚くほど高い値だ。このことから、研究チームは神経細胞におけるハイドロトロープ剤としてのATPの役割に注目した。
細胞内ATP濃度は軸索原形質の粘性と負の相関がある
今回の研究では、健常群、パーキンソン病患者群、ALS患者群から採取したヒト幹細胞由来神経細胞を用いて、細胞内のATP濃度と軸索原形質(神経細胞の軸索内部に存在する細胞質)の粘性、および神経変性疾患に関連するタンパク質(パーキンソン病ではα-シヌクレイン、アルツハイマー病ではタウ、ALSではTDP-43)の溶解度との関係を検討した。
その結果、生理学的および病理学的条件下の両方において、細胞内のATP濃度と軸索原形質の粘性との間に負の相関があることがわかった。例えば、生理条件下において、ATPの局所的な変化が、シナプス前区画の細胞質・シナプス小胞・アクティブゾーンの粘性にも影響を及ぼし、シナプスの機能的構成を変化させることが判明した。
ATP産生促進によって軸索内のタンパク質凝集体が可溶化
ATPは主にミトコンドリアで生成される。ミトコンドリアの機能とATP合成の速度は加齢とともに低下していくが、パーキンソン病やALSのようにミトコンドリアの異常と関連する病気では、ATP濃度はさらに低下する。その結果、タンパク質の溶解度が低下し、細胞質がより粘性を持つようになる。
そこで、ニコチンアミドモノヌクレオチド(NMN)を用いて、ATP産生を促進したところ、ALS神経細胞軸索内のタンパク質凝集体が分解・可溶化し、細胞質流動性が回復することを見出した。
細胞メカニズムの理解が神経変性疾患の予防・治療につながる
今回の研究によって、ATPが神経細胞において細胞質全体の粘性を制御していることが明らかになった。軸索原形質の粘性が高くなると、タンパク質が凝集しやすくなり、細胞に損傷を与える可能性があるが、ATPの産生促進は細胞質の粘性を下げることを見出した。これにより、病的なタンパク質の凝集が分散され、新たな凝集を防ぐことがわかった。
「神経変性疾患の研究は、その多面的な性質ゆえに非常に複雑であり、包括的な治療法の実現にはまだほど遠いのが現状だ。しかし、今回の発見は、これらの疾患の細胞メカニズムの理解に重要な意味を持ち、緩徐に進行する神経変性疾患を包括的に予防・治療できる未来に一歩近づいたことを示している」と、研究グループは述べている。
▼関連リンク
・沖縄科学技術大学院大学 研究関連ニュース



