グレリン受容体作動薬アナモレリン、受容体との結合様式など詳細な機構は未解明
久留米大学は1月21日、がん悪液質治療薬であるアナモレリン(製品名:エドルミズ(R))が結合したグレリン受容体の立体構造を決定したと発表した。この研究は、同大分子生命科学研究所遺伝情報研究部門の椎村祐樹助教、松井一真大学院生、児島将康客員教授、京都大学の岩田想教授、米国サンフォード研究所の増保生郎博士、千葉大学大学院理学研究院の村田武士教授、大阪大学蛋白質研究所の加藤貴之教授、京都工芸繊維大学の岸川淳准教授らの研究グループによるもの。研究成果は、「Nature Structural & Molecular Biology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
グレリンは、Gタンパク質共役型受容体(GPCR)の1つであるグレリン受容体に作用して、成長ホルモンの分泌促進や摂食亢進、体温低下作用を示すことから、「エネルギー貯蓄ホルモン」として知られているペプチドホルモンで、児島教授らの研究グループによって発見された。がん患者や高齢者にとって、効率的なエネルギー貯蓄は治療の継続やQOL向上に重要な役割を果たす。
こうした背景のもと、2021年にグレリン受容体作動薬であるアナモレリンが、がん悪液質の唯一の治療薬として日本で初めて承認された。この医薬品は、食欲不振と体重減少に対して有効であり、がん悪液質に対するFirst-in-classとして期待されている。一方でアナモレリンは、グレリン様作用から推定される筋力増加作用が微弱であるとして欧米では承認に至っていない。アナモレリンを改変してさらに有用な医薬品を開発するためには、アナモレリンの結合様式および細胞内シグナル伝達活性の理解が重要となるが、その詳細は不明なままだった。
アナモレリン結合状態のグレリン受容体、クライオ電子顕微鏡単粒子解析法で立体構造解明
そこで今回、1)アナモレリン結合状態にあるグレリン受容体の立体構造を決定して、その結合様式を明らかにする 2)アナモレリンの細胞内シグナル伝達活性の詳細を解明する 3)一塩基多型(SNPs)がグレリン受容体作動薬に与える影響を検討する、という3点を目標に、研究グループは、次世代の治療薬設計に向けた分子基盤の確立および個別化医療における新しいアプローチの提唱を目指した。
アナモレリンとグレリン受容体の結合様式を明らかにするために、クライオ電子顕微鏡単粒子解析法(Cryo-EM)を用いた。Cryo-EMは、タンパク質立体構造決定のための革新的技術として、2017年にノーベル賞を受賞している。シグナルアッセイには、蛍光共鳴エネルギー移動(FRET)を用いた。作動薬が結合すると、GPCRは構造変化を起こし、その細胞内領域に共役しているGタンパク質三量体のαサブユニットとβγサブユニットが解離することで細胞内シグナルが惹起される。今回の研究で用いたFRETアッセイは、βγサブユニットとGRK(Gタンパク質共役型受容体キナーゼ)を蛍光タンパク質標識することで、GPCRの構造変化と高い相関性を持つ、細胞内シグナル伝達の初期段階を補足できる実験系となっている。
グレリン受容体のリガンド結合ポケットのSNPsを同定するためにgnomAD version 4.0を用いた。およそ80万を超えるヒトゲノム情報からグレリン受容体のSNPsを抽出して、それらを立体構造に組み込むことで、リガンド結合ポケットにみられるSNPsを同定した。
グレリン受容体の細胞内領域構造、アナモレリン結合で変化しシグナル活性を増強
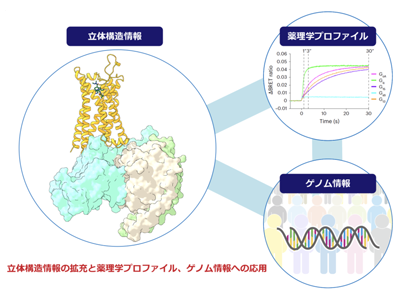
Cryo-EMを用いて、アナモレリン結合型グレリン受容体-Gタンパク質複合体の立体構造を2.9オングストローム分解能で決定した。グレリン受容体のリガンド結合ポケットは、「bifurcated pocket」と呼ばれる、2つのくぼみを有しているが、アナモレリンは、主に比較的大きなくぼみであるCavity Iに収納されて、小さなCavity IIにはインドール基のみが収納されていた。この結合様式は、内因性リガンドであるグレリンや、そのほかのグレリン受容体作動薬の結合様式と類似するものだった。
グレリンまたはアナモレリンが結合したグレリン受容体構造を比較したところ、細胞内領域の構造に顕著な違いがあることが判明した。この構造の違いがシグナル伝達に影響を与えるのではないかと考え、アナモレリンのシグナル活性を測定したところ、アナモレリンは、強いシグナル活性を持つ「スーパーアゴニスト」であることを明らかにした。さらにこのスーパーアゴニスト活性は、Gタンパク質シグナルだけでなく、βアレスチンシグナルでも見られることを明らかにした。
ペプチド性作動薬のシグナル活性が減衰するリガンド結合ポケット周辺のSNPsを発見
ビッグデータ解析によって、グレリン受容体のリガンド結合ポケット周辺に、アミノ酸変異を伴う複数のSNPsを見出した。このSNPsを持つグレリン受容体に対し、ペプチド性作動薬(グレリン、GHRP-6)、低分子作動薬(イブタモレン、アナモレリン)の4種類の作動薬をそれぞれ添加したところ、Asn305Lys(305番目のアスパラギンがリジンに変異したSNPs)で、ペプチド性作動薬のシグナル活性が減衰した。一方、低分子作動薬では、この減衰が見られなかった。そこで構造情報をもとにその分子機序を考察したところ、Asn305はペプチド性作動薬と特異的な水素結合を形成しており、SNPsによってこの相互作用が破綻することが、シグナル活性が消失する要因であると推測した。
がん悪液質治療薬開発や個別化医療などへの貢献につながると期待
今回の研究によって、グレリン受容体標的医薬品の設計を促進する立体構造情報を拡充することができた。さらに、構造情報を活用することで、シグナル伝達の分子基盤や遺伝的多様性の影響を論理的に理解する新たな枠組みを提示した。これにより、個別化医療における薬剤選択の精度向上が期待され、さまざまな疾患の治療に向けた新たな治療法の基盤を構築することができると考えられる。
・グレリン受容体創薬への波及効果:グレリン受容体標的薬は、グレリンの多彩な生理作用からさまざまな疾患への適応が考えられている。特に近年では、グレリンが心不全患者の心拍出量を増大させることから、がん悪液質だけでなく心不全治療薬候補としても研究が進んでいる。この際、今回の研究によって得られたグレリン受容体の立体構造情報は、理論立った医薬品開発に貢献することが期待される。
・がん悪液質治療薬開発への波及効果:アナモレリンは、グレリン様作用から期待される筋肉増強作用がまだ十分でない点が課題である。今回の研究では、アナモレリンがスーパーアゴニストとして、治療に有用と考えられるGタンパク質シグナルだけでなく、薬効を減衰させるβアレスチンシグナルも強力に惹起することを明らかにした。この知見をもとに、βアレスチンシグナル活性の弱いグレリン受容体標的薬を設計することで、より治療効果の高いがん悪液質治療薬の開発が可能になると考えられる。
・個別化医療への波及効果:患者の遺伝情報や病状に応じた個別化医療は、副作用の少ない治療法として期待されている。今回の研究では、立体構造情報、ゲノム情報、医薬品のシグナルプロファイルを統合することで、より適切な個別化医療を提供できる可能性を示唆した。このアプローチはグレリン受容体にとどまらず、ほかのGPCRを対象にした治療にも応用可能であり、医療の新しい基盤を構築するものと考えられる。
▼関連リンク
・久留米大学 研究TOPICS



