哺乳類の細胞の小胞体でコレステロール濃度が5mol%に維持されている理由は不明だった
京都大学は12月8日、細胞膜中のコレステロール濃度を感知し恒常性を保つメカニズムの一端を明らかにしたと発表した。この研究は、同大アイセムス(高等研究院 物質-細胞統合システム拠点)の植田和光特定教授、小笠原史彦特定研究員らの研究グループによるもの。研究成果は、「Journal of Biological Chemistry」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
コレステロールは身体の全ての細胞において、細胞膜の脂質の30〜50%(脂質2〜3個に1個)を占めており、細胞にとって重要な役割を果たしている。一方、細胞内でコレステロールを合成する場である小胞体では、コレステロール濃度は5mol%(脂質20個に1個)に厳密に制御されている。これは、身体の中で最も厳密なレベルの制御だ。どうやって5mol%に制御されているかは、過去の研究で明らかにされているが、なぜ5mol%なのかは不明なままだった。
そこで研究グループは今回、小胞体に存在するセンサータンパク質「SCAP/SREBP」が、細胞膜のコレステロール濃度をどのようにして感知しているのかを明らかにするとともに、哺乳類の細胞の小胞体でコレステロール濃度が、なぜ厳密に5mol%に維持されているのかを明らかにした。
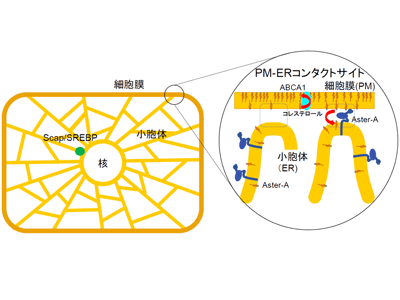
Aster-Aタンパク質が、細胞膜内層で過剰となったコレステロールを小胞体に輸送
Aster-Aタンパク質を培養細胞に発現させると細胞内の小胞体全体に広がって存在するが、培地中にコレステロールを添加すると、Aster-Aはすぐに細胞膜の近くに移動した。
次に、高解像度顕微鏡を用いて細胞膜近傍を観察すると、コレステロールを添加して2〜3分後に、細胞膜近傍にAster-Aのパッチ状構造がたくさん形成されることがわかった。これは、細胞膜中のコレステロール濃度が上昇すると、Aster-Aが細胞膜と小胞体が接触している「コンタクトサイト」に集まることを示している。さらに、低濃度(0.1mM)のコレステロールを添加した条件ではAster-Aがダイナミックに動き、コンタクトサイトに短時間留まった後、拡散する様子が観察されたという。
この結果から、Aster-Aは小胞体全体を自由に拡散しており、通常時はコンタクトサイトをただ通過するだけだが、細胞膜中のコレステロール濃度が上昇すると、Aster-Aは細胞膜中のコレステロールに結合することによってコンタクトサイトに一時的に停止し、コレステロールを濃度勾配に従って移動させ、細胞膜と小胞体膜の間でコレステロールの平衡を保っていることが判明した。
ABCA1により、細胞膜内層のコレステロールが低濃度に維持されていた
このようなコレステロール濃度上昇によるAster-Aのコンタクトサイトへの移動は、細胞にABCA1を発現させると起こりにくくなり、細胞膜上のABCA1発現量とAster-Aのコンタクトサイトへの移動量が反比例することが明らかになった。
ABCA1は細胞膜中の過剰なコレステロールを血中のアポA-Iタンパク質に渡してHDLとして排出することが知られているが、その活性とは別に、細胞膜内層のコレステロールを外層へ動かし細胞膜内層のコレステロール濃度を低下させる働きを持つことが最近判明した。Aster-Aがコンタクトサイトに移動しないのは、ABCA1によって細胞膜内層のコレステロール濃度が低く抑えられているためと考えられるという。
5mol%を超えると、過剰なコレステロールはAster-Aにより小胞体へ輸送される
研究グループが提唱しているコレステロール恒常性維持メカニズムによると、LDLは細胞膜上の受容体とともに細胞内に取り込まれてリソソームで分解され、遊離したコレステロールは、まず細胞膜へ運ばれた後、Aster-Aによって小胞体へと運ばれる。
細胞膜では、ABCA1がコレステロールを内層から外層へ移動させることによって、内層のコレステロール濃度を小胞体の濃度である5mol%以下に維持しており、5mol%以下の場合はAster-Aはコンタクトサイトで留まらないため、コレステロールの小胞体への輸送は起きない。5mol%を超えると、過剰なコレステロールはAster-Aによって小胞体へ輸送される。小胞体のコレステロール濃度が5mol%を超えると、SCAP/SREBP複合体は核へ運ばれなくなり、コレステロール合成に関わる遺伝子と、LDL受容体遺伝子の発現誘導が止まる。さらに、ABCA1の発現誘導が始まり、細胞膜中の過剰なコレステロールはHDLとして細胞外へ排出される。
コレステロールが細胞膜内でシグナル分子として重要な働きをしている可能性
研究グループは、これまでに、哺乳類の細胞の細胞膜のコレステロール濃度は、外層が30〜50mol%で内層が3〜4mol%であり、外層と内層で10倍の濃度勾配が形成されていることを提唱してきたが多くの反論があり、議論が分かれていた。しかし、今回の研究は、細胞膜内層のコレステロール濃度が5mol%以下であることを示しており、議論に決着をつけると期待されている。なぜ、細胞膜外層と内層のコレステロール濃度の間に10倍の濃度差をつける必要があるのかについては、コレステロールが細胞膜内でシグナル分子として重要な働きをしているためと考えられる。
細胞が用いているシグナル分子としては、細胞内外で1万倍の濃度差があるカルシウムイオン、膜の局所で一時的に合成されるホスホイノシタイドやcAMPがよく知られているが、コレステロールも細胞膜内層濃度の局所的な変化がシグナルとして働いていると考えられる。
ABCA1、Aster-A、Scapのアミノ酸配列は、哺乳類、鳥、魚で高度に保存されており、膜脂質としてコレステロールをもつ脊椎動物において、このシステムが進化してきたことがわかる。脊椎動物は、コレステロールを発生や組織形成を調節する細胞膜内シグナル分子として利用することにより、さまざまなボディープランを進化させることに成功し、最終的にヒトが地球上に現れることを可能にしたのではないか。そのように考えると、身体で働いているABCA1の第一の生理的役割は、HDLを産生することではなく、細胞膜内でコレステロールの非対称的な分布を作り出すことであり、HDLは細胞膜内層に存在する過剰なコレステロールを取り除くために働いた結果とも考えられる。
過剰なコレステロールで病理的な悪影響が生じるのはシグナル制御の破綻が原因の可能性
過剰なコレステロールにより病理的な悪影響が生じるのは、シグナル制御の破綻が原因の可能性がある。「今後、コレステロール恒常性やHDLの役割を別の角度から見ることが、さまざまな病気の予防や治療に役立つと考えている」と、研究グループは述べている。
▼関連リンク
・京都大学アイセムス 物質-細胞統合システム拠点 研究



