社会的課題となっている「診断難民」、遺伝子解析のみでは解釈に不十分
順天堂大学は11月21日、長年原因不明の症状に苦しむ患者を対象に、全ゲノム解析とAIによるタンパク質構造予測を組み合わせた統合解析を実施し、病気の原因となる遺伝子変化を特定したと発表した。この研究は、同大大学院医学研究科小児思春期発達・病態学の村山圭教授、難治性疾患診断・治療学/難病の診断と治療研究センターの岡﨑康司教授、八塚由紀子准教授、東京大学先端科学技術研究センターの石北央教授、熊谷晋一郎教授、斉藤圭亮准教授らの研究グループによるもの。研究成果は、「Frontiers in Molecular Biosciences」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
多くの患者が、長年にわたり原因不明の体調不良や慢性症状に苦しみながら、医学的に明確な診断が得られないまま放置される、いわゆる「診断難民」の問題は深刻な社会的課題となっている。これらの患者の中には、全ゲノム解析を受けて変異が見つかってもその意味がわからず、診断に結びつかないケースが少なくない。その背景には、遺伝子変化がタンパク質の立体構造や機能にどのような影響を及ぼすかを分子レベルで解釈する手法が限られてきたことがある。
全ゲノム解析とAI構造予測技術を組み合わせた解析、数十年原因不明の患者を対象に実施
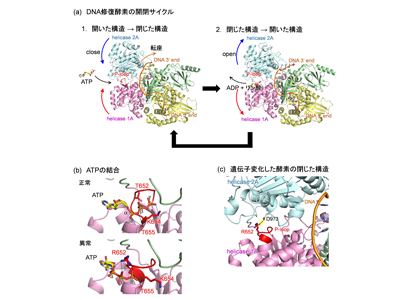
研究グループは、数十年にわたって診断がつかず、国内外の多数の医療機関を受診しても原因不明とされてきた1人の患者を対象に解析を行った。全ゲノム解析の結果、アミノ酸置換を伴う遺伝子異常が特定された。その変異遺伝子がコードするタンパク質の立体構造を把握できれば、どの機能が損なわれ、最終的にどのように症状が現れるかを分子レベルで推定できる。しかし、従来の構造決定の手法(X線結晶構造解析法やクライオ電子顕微鏡法)では、試料調製から構造決定まで長い時間と労力を要し、また構造が必ず決定できる保証もない。そこで研究グループは、2024年のノーベル化学賞の対象となったAI構造予測技術を用いて変異体の立体構造を迅速に推定し、DNA修復に関わる酵素の活性の要となる部位に異常が及ぶ可能性を明らかにした。
タンパク質構造の「ゆがみ」発見、酵素の開閉サイクル阻害するメカニズム解明
DNA修復酵素は、エネルギー源となるATPを結合して働く。ATPが結合していないときは(ATP結合部位が)「開いた構造」にあり、ATPが結合すると「閉じた構造」になってエネルギーを使う。その後、使い終えた分子を手放すと開構造に戻る、というような開閉サイクルで働く。
ところが、この研究で特定した遺伝子変化では、ATPをつかまえる”指”の位置がわずかにずれ、本来はくっつかない部分どうしが思わぬ”結びつき”を作ってしまい、ふたが閉じたまま戻りにくい状態になりがちである。その結果、ATPの収まりと開閉サイクルが乱れ、DNA修復に不可欠な酵素活性が低下する可能性が高いことがわかった。
このように、AIが予測した立体構造を活用することで、従来の塩基配列解析だけでは判断できなかった「構造のゆがみ」や「機能低下のメカニズム」を視覚的かつ分子科学的に明らかにした。遺伝子情報とタンパク質構造の変化を結びつけて病因を具体的に読み解く実践的な枠組みを示した成果である。
新たな診断アプローチ、患者自身の理解や心の支えにもつながる可能性
この研究は、原因不明の症状の背後に潜む「見えなかった原因」を構造から捉える新たな道を拓いたもの。ゲノム・構造・分子機構を統合するこのアプローチの普及によって、未診断疾患における機序解明と診断支援が加速し、診断難民を支える一助となることが期待される。
さらに、この研究のようなタンパク質構造に基づく可視化による理解は、医師や研究者だけでなく、患者自身が「自分の身体の中で何が起きているのか」をより直感的に理解する手がかりにもなる。たとえ現時点で治療法が確立していなくても、その分子レベルの機序が明らかになることで、患者が自らの症状を理解しやすくなり、心の支えとなる可能性がある。「科学的な可視化を通じて、患者自身の理解と受容を支えることも、この研究の重要な意義の一つである」と、研究グループは述べている。
▼関連リンク
・順天堂大学 ニュース&イベント



