PDAC治療のカギとなりうるビタミンB群、がん形成において果たす役割は未解明
北海道大学は6月30日、すい管腺がん(PDAC)の新たな代謝的脆弱性としてニコチンアミドアデニンジヌクレオチド(NAD)合成経路を同定し、さらにNAD合成経路の下流で機能するGPx4がPDACの治療標的であることを明らかにしたと発表した。この研究は、同大学遺伝子病制御研究所がん制御学分野の園下将大教授、株式会社フライワークスらの研究グループによるもの。研究成果は、「Molecular Therapy」オンライン版に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
すい臓に発生するがんの大部分を占める「すい管腺がん(PDAC)」は、5年生存率がわずか10%という極めて予後不良ながんであり、診断時点で多くの患者がすでに手術不能な進行期にある。加えて、化学療法や放射線療法の効果も限定的であるため、新たな治療法の開発が強く求められている。
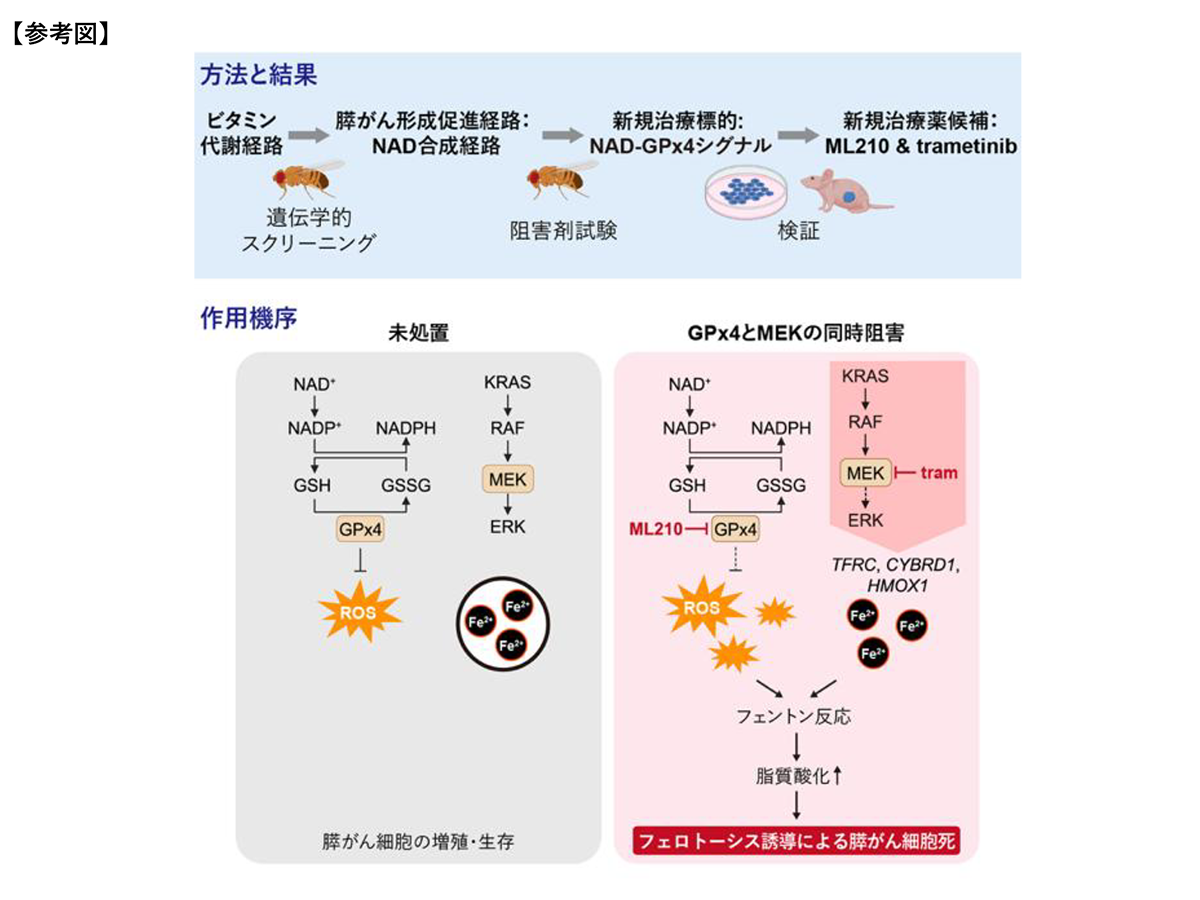
研究グループは近年、PDAC患者の中でも最も予後が悪い患者群が有する4つの遺伝子変異(がん遺伝子KRASの活性化とがん抑制遺伝子TP53・CDKN2A・SMAD4の不活性化)を再現した「4-hitモデルショウジョウバエ(以下、4-hitハエ)」を確立した。このモデルを用いてキナーゼの網羅的なスクリーニングを実施した結果、MEK、AURKB、GSK3といったPDACの新規治療標的を同定することに成功した。この過程で、リボフラビン(ビタミンB2)をリン酸化する酵素であるリボフラビンキナーゼ(RFK)も、有望な治療標的候補として浮上した。リボフラビンは、フラボタンパク質の補酵素であるFMNやFADの前駆体であり、細胞内の酸化還元反応や抗酸化機構に不可欠なビタミンである。RFKやフラボタンパク質は、ナイアシン(ビタミンB3)、葉酸(ビタミンB9)、ピリドキシン(ビタミンB6)など他のビタミン代謝とも密接に関わっており、がんをはじめとするさまざまな疾患との関連性が注目されている。しかし、これらのビタミン代謝がPDACの形成において果たす役割については、これまでほとんど明らかにされていなかった。
抗酸化酵素GPx4がPDACの治療標的になることを同定
今回の研究では、まず、PDACの新規治療標的を同定すべく、4-hitハエを用いてビタミン代謝経路に関わる遺伝子の機能を網羅的に探索した。その結果、機能を阻害することで4-hitハエの致死性を改善する23遺伝子を特定した。特にビタミンB3の代謝を駆動するNAD合成経路が重要であることが示唆され、この経路の下流で機能する遺伝子のうちGPx4を有望な治療標的として同定された。そこで、GPx4阻害剤ML210を、研究グループがPDAC形質を抑制する効果を見出していたMEK阻害薬trametinibと同時に4-hitハエに投与し、このハエの生存率が有意に上昇することを見出した。ヒトPDAC細胞AsPC-1を用いたスフェロイド培養及び軟寒天アッセイにおいても、この2剤の併用は細胞増殖を強力に抑制する効果を示した。
GPx4阻害剤とMEK阻害剤の併用療法、単剤よりも高い腫瘍成長抑制効果
研究グループは次に、これらの発見の臨床的妥当性を検証すべく、ヒトPDAC手術検体のシングルセルRNAシーケンス解析を実施した。その結果、GPx4の発現ががん上皮細胞で特に高く、加えてこれらの細胞ではグルタチオン代謝やフェロトーシス(鉄依存性の細胞死)関連の遺伝子スコアも高いことから、PDACはフェロトーシスへの感受性が高いことが示唆された。実際に、免疫不全マウスのすい臓にAsPC-1細胞を移植した同所性移植PDACモデルにおいても、ML210とtrametinibの併用治療は、各々の単剤よりも高い腫瘍成長抑制効果を示した。
既存治療に抵抗性のすい管腺がんに対する新たな治療戦略に
今回の研究成果は、フェロトーシスの誘導を基盤とした新たなPDAC治療戦略の確立に向けた、重要な第一歩となるものである。「今後、よりヒトに近い形で非臨床試験を行うべく、他の動物モデルを使用した解析などを推進することで、既存の治療法に対して高い抵抗性を示してきたPDACの克服に向けて、新たな治療の選択肢と希望をもたらすことにつながる」と研究グループは述べている。
▼関連リンク
・北海道大学 プレスリリース



