UPF1はRegnase-1による炎症性サイトカインmRNA分解を手伝うのか
京都大学は7月25日、RNAヘリカーゼUPF1によるRNAの構造変化をスイッチとするmRNA分解が、炎症反応の巧妙なブレーキとして機能することと、これがSMG1キナーゼにより活性化されることを解明したと発表した。この研究は、同大学大学院医学研究科の竹内理教授らの研究グループと、宮崎大学、東京大学、大阪大学、理化学研究所、横浜市立大学との共同研究によるもの。研究成果は、英国の国際学術誌「Nucleic Acids Research」にオンライン掲載された。
画像はリリースより
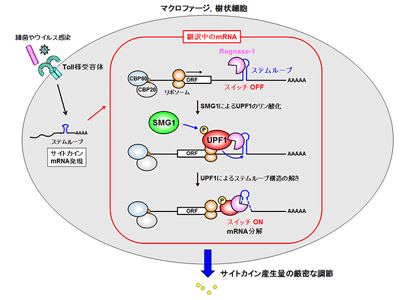
過剰な炎症は敗血症性ショックや、自己免疫疾患、動脈硬化、代謝性疾患などを引き起こす原因となる。そのため、生体には、炎症を精緻にコントロールする機構が備わっており、その破綻が炎症性疾患の発症に関連すると考えられている。炎症の調節においては、炎症性サイトカインの量が中心的な役割を果たしている。マクロファージにおいて炎症性サイトカインのmRNAは、単に転写で作られるだけでなく、分解されることでその量が調節されている。研究グループは以前、RNA分解酵素「Regnase-1」を発見し、この分子が炎症性サイトカインmRNAを分解してその産生を負に調節するブレーキであることを報告した。さらにRegnase-1は標的mRNA上のステムループ構造を認識し、UPF1と呼ばれるヘリカーゼタンパク質と協調的に作用して、タンパク質翻訳を行っている炎症性mRNAを分解することも報告した。しかしながら、どのようにUPF1がRegnase-1によるmRNA分解をサポートしているかは未解明だった。
SMG1-UPF1-Regnase-1経路によるRNA分解が免疫応答制御に重要
Regnase-1は、翻訳したmRNAを特異的に分解する。そこで研究グループはまず、Regnase-1が翻訳により標的mRNAに結合し、分解する可能性を検証した。しかし、薬剤でタンパク質合成を止めても、Regnase-1と標的 mRNAの結合を認め、また試験管内で、Regnase-1タンパク質がステムループRNA を分解しなかったことから、Regnase-1は、翻訳と関係なく mRNAに結合し、また、翻訳していない場合には、Regnase-1が結合していても標的 RNA を分解できないことがわかった。この結果は、翻訳によって、Regnase-1によるRNA分解をONにする機構が存在することを示唆している。Regnase-1 はUPF1と結合するため、UPF1がRegnase-1によるmRNA分解のスイッチとなっている可能性を検証した。その結果、Regnase-1はUPF1共存下でステムループ RNA を素早く切断すると判明。さらに、最初にステムループRNAをUPF1と混ぜることで、ステムループ RNA が巻き戻されて一本鎖となり、これがRegnase-1により素早く分解されることが明らかとなった。これらの結果は、UPF1がステムループRNAをほどくことがRegnase-1によるRNA切断のスイッチになっていることを示す。
そこで研究グループは次に、UPF1によりスイッチがONになるメカニズムを解析した。Regnase-1とUPF1は翻訳終結により結合するが、この際に、UPF1のT28残基がリン酸化を受けることが必要であると判明。さらに、UPF1 T28A変異体の再構成実験により、このUPF1のリン酸化はRegnase-1によるRNA分解にも必須であることが明らかになった。このUPF1のリン酸化を誘導しているキナーゼの同定を試みたところ、PI3キナーゼファミリーの1つであるSMG1によるUPF1のリン酸化がRegnase-1とUPF1の結合およびRegnase-1によるRNA切断に必須であることがわかった。つまり、SMG1によるUPF1のリン酸化がRegnase-1との安定的な相互作用を形成し、そしてUPF1がステムループRNAを解くことでRegnase-1が標的ステムループRNAを切断すると考えられる。SMG1はmRNA品質管理機構では、異常な翻訳の終結により活性化することが知られており、Regnase-1による標的mRNAの分解に際しても翻訳に依存して活性化する可能性が考えられた。
最後に研究グループは、Regnase-1によるmRNA分解にSMG1が必須であることが解明されたので、SMG1のキナーゼ活性を操作することで、免疫応答をコントロールできるかどうかを検証。樹状細胞をSMG1阻害剤で処理し、炎症性サイトカインmRNAの発現量を測定した結果、Regnase-1の標的の炎症性サイトカインmRNAの発現がSMG1阻害剤の処理により亢進していた。樹状細胞が病原体の認識により活性化すると、細胞表面のCD40およびCD80共刺激分子の発現量が増加することが知られているが、SMG1 阻害剤の処理により、樹状細胞のCD40およびCD80の発現量が増加していた。このCD40とCD80のmRNAもRegnase-1の標的であることが遺伝子発現解析により確認された。さらに、樹状細胞とT細胞の同種リンパ球混合培養反応により、SMG1阻害剤で活性化した樹状細胞がT細胞の活性化も誘導することがわかった。つまり、SMG1のキナーゼ活性を操作することで、樹状細胞による自然免疫応答を活性化し、さらにT細胞の獲得免疫の活性化も誘導することが明らかとなった。
自己免疫疾患や炎症性疾患などの創薬ターゲットとして期待
今回の研究では、UPF1によるRNAの2次構造変化およびSMG1によるUPF1のリン酸化がRegnase-1によるRNA分解を介して炎症を制御していることが解明された。今後、ヒト自己免疫疾患や炎症性疾患におけるSMG1、UPF1およびRegnase-1の機能を検討することで、これらの疾患の病態解明につながることが期待される。UPF1およびRegnase-1の機能を変化させることは、自己免疫疾患や炎症性疾患などの創薬ターゲットとなることが期待される。また、「SMG1を阻害することで、自然免疫応答を活性化することが示されたことから、SMG1阻害剤が、ワクチン効果を増強する新規のワクチンアジュバントとして使用できる可能性も考えられる」と、研究グループは述べている。
▼関連リンク
・京都大学 研究成果



