機能性アミロイド、細胞「内」の毒性回避はどのように?
東京慈恵会医科大学は9月17日、大腸菌が細胞の外で作る特殊なアミロイドの材料タンパク質を、細胞の中で安全に処理するための仕組みを発見したと発表した。この研究は、同大細菌学講座/アミロイド制御研究室の杉本真也准教授・室長、医学科ユニット医学研究専攻の寺澤友梨香氏(2022年卒)、細菌学講座の金城雄樹講座担当教授、熊本大学発生医学研究所の山中邦俊准教授らの共同研究グループによるもの。研究成果は、「Journal of Molecular Biology」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
タンパク質は正しく折り畳まれて立体構造をつくることで、本来の機能を発揮する。ところが、ストレスや遺伝子変異などの影響で折り畳みに失敗すると、構造が壊れたり(変性)、異常な形のまま集合して「凝集体」と呼ばれる塊をつくる。なかでも「アミロイド」と呼ばれる線維状の凝集体は、アルツハイマー病やパーキンソン病といった神経変性疾患の発症と深く関わっていることが知られている。
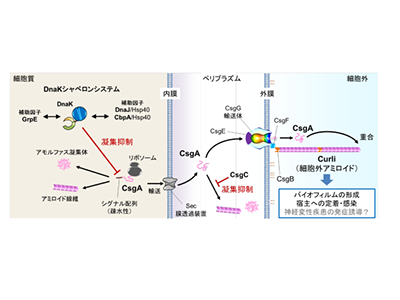
一方で、細菌はあえて「機能性アミロイド」を細胞の外に作り出し、バイオフィルムと呼ばれる集団構造を築く戦略をとる。代表的な例が、大腸菌のCurliである。Curliは細菌にとって有用であるが、材料となるCsgAタンパク質が細胞内にたまると毒性を示すため、細菌にとってもリスクを伴う。しかし、これまでCsgAが細胞内でどのように分解され、毒性を回避しているのかはわかっていなかった。
大腸菌はプロテアーゼでCurli材料タンパク質CsgAを分解、毒性化を防ぐ
今回の研究で、大腸菌はタンパク質分解酵素(プロテアーゼ:Prc)を使って、Curliの材料タンパク質CsgAを細胞の中で分解し、毒性化を防いでいることがわかった。
大腸菌、複数の安全機構で機能的アミロイドの毒性を回避
また、Prcはペリプラズム(細胞質膜と外膜の間の空間)に存在する分子シャペロンCsgCと協調し、アミロイド様凝集体の蓄積を防いでいることがわかった。分解や細胞外への分泌が滞ると、大腸菌はRcs経路およびCpx経路という二成分制御系を介してCsgAの発現を転写レベルで抑制し、さらなるアミロイドの蓄積を防いでいることが明らかになった。
これらの結果から、大腸菌は「タンパク質分解」と「タンパク質凝集抑制」、および「転写制御」という複数の安全機構で、機能的アミロイドの毒性を回避していることが明らかになった。
バイオフィルム形成制御に向けた新規分子標的提供などに期待
今回の成果は、細菌における機能性アミロイドの品質管理と毒性回避機構の全貌に迫る重要な知見である。今後、バイオフィルム形成制御に向けた新規分子標的の提供、難治性細菌感染症の治療法開発への応用、ヒトのアミロイド関連神経変性疾患研究への基盤知識の提供、生物工学・バイオマテリアル分野における「効率的な機能性アミロイド利用技術」開発への応用が期待される、と研究グループは述べている。
▼関連リンク
・東京慈恵会医科大学 プレスリリース



