移植後の再発リスクが高いCD19陽性B-ALL、維持療法は未確立
国立成育医療研究センターは8月6日、難治性または再発性のB細胞性急性リンパ性白血病(B-ALL)に対して同種造血細胞移植を受けた小児・AYA(思春期・若年成人)患者に、免疫療法薬ブリナツモマブ(blinatumomab)を用いた第1相臨床試験を実施し、この維持療法が安全に実施可能であることを発表した。この研究は、同センター小児がんセンターの坂口大俊氏、京都大学大学院医学研究科研究グループの梅田雄嗣氏、加藤格氏、浜松医科大学医学部附属病院の坂口公祥氏らが中心となり、特定非営利活動法人日本小児がん研究グループ(JCCG)が臨床試験を実施したもの。研究成果は、「Haematologica」に掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
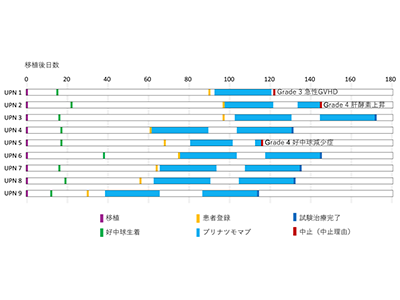
小児・AYAの難治性または再発性CD19陽性B-ALLに対し、造血細胞移植は重要な根治療法ではあるものの移植後再発リスクが依然として高く、移植後維持療法は未確立である。今回の試験では、移植後30~100日以内にブリナツモマブを2コース(各4週間)投与する移植後維持療法について、主にその安全性を評価することを目的とした。
登録患者の67%がブリナツモマブ治療を完遂、良好な忍容性を示す
今回の研究は、JCCGの造血細胞移植・免疫細胞療法委員会が主導し、全国85の小児がん治療施設が参加した多施設共同第1相臨床試験である。再発性/難治性CD19陽性B-ALLの小児およびAYA世代の患者を対象に、同種造血細胞移植後の早期(移植後30~100日以内)に免疫療法薬ブリナツモマブを投与し、その安全性および実施可能性を検証した。主要な評価項目は治療完遂率(66%以上で次の試験に進行可能)とし、副次評価項目として治療関連有害事象(Grade3以上)を評価した。
結果、登録患者全員(9人)が第1コースを完了し、6人(67%)が計画通り2コースを完遂した。事前に設定した安全性基準を達成し、次の試験への進行基準を満たした。Grade3以上の有害事象は一部に認められたものの、致死的な合併症は認められず、ブリナツモマブの投与は全体として良好な忍容性を示した。また、治療期間中および観察期間内(中央値341日)において、再発・死亡は1例も発生しなかった。治療開始前に末梢血中に検出されていたCD19陽性B細胞は、治療後には全例で消失し、中央検査機関による骨髄評価でも、2コース終了時に評価可能であった8例すべてが微小残存病変陰性を確認できた。これらの結果は、移植後の早期にブリナツモマブを導入する方法が、安全かつ再発予防の有力な手段となり得ることを示唆している。
移植後早期のブリナツモマブ維持療法導入が、再発予防の新戦略に
今回の研究成果は、移植後早期にブリナツモマブ維持療法を導入することで再発予防の新戦略が構築可能であることを示唆している。「血液毒性や移植片対宿主病(GVHD)悪化のリスクを抑えた安全な治療導入が実現可能となり、次の試験ではさらに多数例での有効性の解析が予定されている。次の試験で有効性が確認されれば、小児・AYA世代のCD19陽性B-ALLにおける新しい標準治療に発展し、治療成績の向上や再発リスクの低減に貢献することが期待される」と、研究グループは述べている。
▼関連リンク
・国立成育医療研究センター プレスリリース



