LGMDR1の責任遺伝子産物カルパイン3、骨格筋での働きや分解する基質は未解明
東京都医学総合研究所は4月23日、肢帯性筋ジストロフィーR1(LGMDR1)の責任遺伝子産物「カルパイン3」の筋細胞における動態の解明とその基質の同定に成功したと発表した。この研究は、同研究所カルパイングループの久恒智博主席研究員、小野弥子プロジェクトリーダー(当時)らの研究グループによるもの。研究成果は、「Journal of Biological Chemistry」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
LGMDR1は、四肢の近位筋の筋力低下を特徴とする、10万人に約2人の割合で発症する難病である。患者の多くは思春期以降に発症し、徐々に筋力の低下が進行して、30歳前後に車椅子を必要とすることが知られている。これまでに根治的な治療法は確立されていない。
1990年初頭にLGMDR1の責任遺伝子としてカルシウム依存性システインプロテアーゼのカルパイン3が同定された後、LGMDR1の発症機序を明らかにするためにカルパイン3の生化学的な特徴が数多くの研究者により研究されてきた。その結果、カルパイン3が古典型カルパインと違いプロテアーゼ領域内に挿入配列を有すこと、そのため自己消化による挿入配列の排除が他の基質の分解に必要なこと、筋原線維のサルコメアを構成する構造タンパク質の一つ”タイチン”に相互作用する分子であることなどが明らかにされてきた。しかし、その急速な自己消化特性のために、骨格筋におけるその活性化メカニズムと生理学的機能はいまだ完全に明らかになっておらず、特に、カルパイン3が筋細胞内においていつどこで活性化し、何を基質として分解するかは大きな未解決問題となっている。
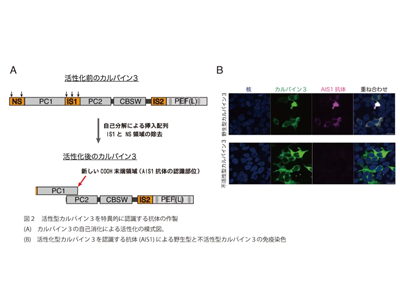
活性化型カルパイン3を特異的に検出する抗体を開発
今回研究グループは、活性化する際のカルパイン3の自己消化に着目し、自己消化によって生じるタンパク質断片の末端のみ認識する抗体の作製に挑戦した。その結果、野生型カルパイン3は認識するが、不活性型カルパイン3を認識しない抗体の作製に初めて成功しAutolytic site within IS1(AIS1)抗体と名づけた。このAIS1抗体により、培養細胞に強制発現させたカルパイン3が強心配糖体のウアバインにより活性化する様子を可視化することが可能になった。さらにこの活性化の際には、大きな細胞内カルシウムの上昇は起こらず、持続的でわずかなカルシウム上昇のみ起こることもカルシウムイメージング法により明らかにした。
静止状態ではサルコメアのMバンドに局在し、活性化で細胞質へ移行と判明
次に研究グループは、初代培養した骨格筋細胞に発現するカルパイン3の細胞内局在について調べた。その結果、静止状態の骨格筋細胞においてカルパイン3がサルコメアのMバンドに主に局在することを明らかにした。さらにウアバイン刺激により、カルパイン3がMバンドから細胞質へ移行することを明らかにした。このカルパイン3の局在変化は、カルパイン3の活性欠損型変異体のノックインマウスから得られた骨格筋細胞では見られなかった。このことから、カルパイン3のプロテアーゼ活性は、カルパイン3の細胞内局在変化に必須ということを証明した。
カルパイン3の生体内基質としてスペクトリンとタリンを特定
最後に、活性化してMバンドから細胞質に移行したカルパイン3が何を基質とするのか調べた。その結果、これまでに試験管内でカルパイン3が分解することが報告されていた細胞骨格タンパク質のスペクトリンとタリンの分解がカルパイン3の活性化の時間経過に同調して見られた。その一方、それらの分解はカルパイン3を欠損した筋細胞では起こらなかった。このことから、スペクトリンとタリンが骨格筋細胞におけるカルパイン3の内在性の基質であることが強く示唆された。
さらなる基質同定によりLGMDR1の治療法開発へ発展すると期待
今回の研究によって、カルパイン3のプロテアーゼ活性は、骨格筋サルコメアのMバンドから細胞質へのカルパイン3の移動に必要なこと、また細胞骨格タンパク質のスペクトリンやタリンの分解に必要なことを明らかにした。LGMDR1の患者に見つかるカルパイン3には、プロテアーゼ活性が弱い変異体が報告されており、カルパイン3によるスペクトリンやタリンの分解が起こらないことがLGMDR1発症のメカニズムの一部になっていると考えられる。
また今回、ウアバインが細胞内カルシウムを持続的かつわずかに上昇させることでカルパイン3を活性化させることが明らかとなった。カルパイン3は筋細胞の収縮時に起こる一過性の大きなカルシウム上昇では活性化しないとされている。筋細胞内で持続的かつわずかにカルシウム上昇させるような生理学的条件は何なのか、またわずかなカルシウム上昇でもカルパイン3が活性化するのはどうしてなのか今後明らかにする必要がある。「この実験系を利用して今後さらにカルパイン3の基質の同定を進めることでLGMDR1の発症機序に新しい知見を与えることができ、それをベースにしたLGMDR1の治療法の開発に発展することが期待される」と、研究グループは述べている。
▼関連リンク
・東京都医学総合研究所 TOPICS



