DMDで行われるエクソンスキッピング療法、さらなる効果向上が求められている
東京科学大学は5月22日、アンチセンス核酸(ASO)の効果を大幅に向上させるヘテロ2本鎖核酸(HDO)技術を応用し、モルフォリノ核酸(PMO)とは異なるDNAおよび糖鎖化学修飾(LNA)を基本骨格とするスプライススイッチングオリゴヌクレオチド(SSO:Splice-switching oligonucleotide)の活性向上手法を検討したと発表した。この研究は、同大脳神経病態学分野の横田隆徳名誉教授、長谷川樹里非常勤講師、核酸・ペプチド創薬治療研究センターの吉岡耕太郎特任講師、大阪大学大学院薬学研究科生物有機化学分野の小比賀聡教授、下剛典大学院生(研究当時)らの研究グループによるもの。研究成果は、「Molecular Therapy – Nucleic Acids」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
核酸医薬を用いたプレ-mRNAのスプライシングの調節は、デュシェンヌ型筋ジストロフィー(DMD)や脊髄性筋萎縮症(SMA)を含む多くの遺伝性疾患に対する有望な治療戦略であり、まれな突然変異や遺伝性疾患に対する個別化治療である「n-of-1療法」にも応用が可能である。具体的には、SSOと呼ばれるアンチセンス核酸医薬は、プレ-mRNAの標的領域に結合し、スプライシング因子の結合を阻害することで、mRNAの編集を通じてタンパク質発現を調節する。
DMDは、X染色体劣性遺伝の疾患であり、ジストロフィン遺伝子の異常によってジストロフィンタンパク質が産生されず、筋肉の変性や壊死が徐々に進行する難治性の病気である。近年では、異常のあるジストロフィン遺伝子内のエクソンを「読み飛ばす(エクソンスキッピング)」ことで、短縮型ながらも機能を有するジストロフィンタンパクを産生させるエクソンスキッピング療法が、一部の遺伝子変異を有するDMD患者に対して実施されるようになった。この療法に用いられるのが、ASOの一種であるSSOである。日本国内でも複数のSSOが承認されているが、さらなる効果の向上が求められている。加えて、近年の研究では、ペプチドや低分子との結合などを通じたSSOの標的組織・細胞への送達効率の向上が注目されている。
高い核内送達性のあるHDO技術、LNAを基本骨格とするSSOにも応用可能か
そこで研究グループは、独自に開発した新規核酸医薬技術であるHDO技術について、その核内への高い送達性に着目し、このHDO技術を応用したSSO(HDSSO)の開発を進めることにした。一方で、PMOや2’OMe RNAと相補鎖を組み合わせたHDSSOの報告はあるものの、LNAを基本骨格とするSSOへのHDO技術の応用は未報告であり、その構造設計と活性との関係も明らかではなかった。
そこで今回の研究では、エクソンスキッピング効率を高めるために必要な核内への効率的送達を実現することを目的として、DNAおよびLNAを基本骨格とする核酸を用いたHDSSOの開発に取り組んだ。具体的には、まずin vitroアッセイにより相補的オリゴヌクレオチドの最適化を行い、その後、最適化したHDSSOをDMDモデルマウスであるmdxマウスに投与し、その治療効果を検討した。
相補鎖としてDNA・RNA・2′-OMe RNAホスホロチオエート修飾を検討、1本鎖SSOと比較
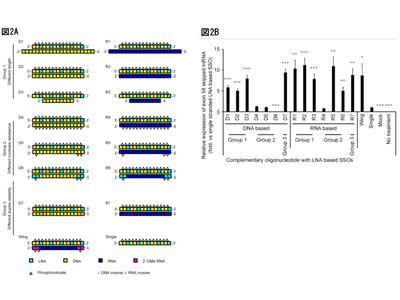
まず、HDSSO技術がLNAベースのSSOおよび2′-OMe RNAベースのSSOに応用可能かを検討した。ジストロフィン遺伝子を標的とした各SSOに対して、相補鎖としてDNA、RNA、または2′-OMe RNAホスホロチオエート修飾(Wing)を含む3種類を設計し、1本鎖SSO(Single)とHDSSOのエクソンスキッピング活性をin vitroで比較した。
HDSSO活性は相補鎖の種類・長さ・化学修飾により異なるが、1本鎖SSOより高い
その結果、HDSSOはいずれのベースでもSingleよりも高い活性を示した。また、相補鎖の融解温度(Tm)測定では、DNA鎖の結合安定性が最も低い結果となった。
次に、相補鎖の構造がHDSSOの活性に与える影響を3つのグループで評価した。
グループ1では、9~21 merの長さの異なるDNA(D1~3)、またはRNA相補鎖(R1~3)を用いたHDSSOを比較し、DNAベースでは9 mer(D3)が最も高い活性を示した。RNAベースでは明確な差はなかった。
グループ2では、PS結合やLNA修飾の有無を変えた相補鎖を設計し、活性を評価した(D4~6、R4~6)。全PS修飾のR4やD4は低活性だったが、5’/3’末端のみPS修飾のR5は高い活性を維持し、LNAを加えたR6は中程度の活性を示した。
グループ3では、相補鎖中のグアニンをイノシンに置換(G>I)したD7とR7を設計した。G>I置換により、HDSSOの結合親和性(Tm値)が低下すると考えたが、DNAベースHDSSOでは活性が上昇したが、RNAベースでは有意な変化は見られなかった。
高活性HDSSOは時間とともに核内から相補鎖消失、低活性では相補鎖分解遅れる
次に、細胞内でのHDSSO挙動を評価するため、グループ2の相補鎖R4〜R6とコントロールとしてwing、R2、Singleを用いて、SSOおよび相補鎖を蛍光標識してタイムラプス観察を行った。導入30分後には全てのHDSSOで核内に両蛍光が確認された。活性の高いR2やR5を含むHDSSOでは、時間経過とともに赤色蛍光(相補鎖由来)が減少し、相補鎖が核内から消失したと推測された。一方、R4を含むHDSSOでは赤色蛍光が長時間残存し、相補鎖の排出・分解の遅れが活性低下の一因と考えられた。
DMDモデルマウスでHDSSO評価、優れたエクソンスキッピング効果確認
最後に、R5設計に基づいたHDSSOを用いたin vivo評価を行った。mdxマウスの変異に合わせてSSO配列を再設計し、R5相補鎖のHDSSOおよび全PS結合のHDSSO(full PS)を投与した。筋注後、HDSSOはfull PSより高いエクソンスキッピング活性を示し、Singleよりも効果的だった。IHC解析ではHDSSOのジストロフィンタンパク質の発現増加が確認され、ウエスタンブロッティングでもHDSSOがSingleより高い発現を示した。
今回の研究により、HDSSOの活性は相補鎖の種類、長さ、修飾に大きく依存すること、また細胞内での相補鎖の挙動が活性に影響することが明らかとなった。さらに、in vivoにおいてもHDSSOの優れたエクソンスキッピング効果が確認された。
さまざまな標的組織でのスプライシング制御型治療法の基盤になりうる
デュシェンヌ型筋ジストロフィーは、依然として有効な治療法が確立されていない遺伝性疾患であり、新たな核酸医薬の開発が期待されている。今回の研究では、核内送達を効率化するヘテロ2本鎖核酸(HDO)技術をDNAおよびLNAベースのSSOに初めて応用し、優れたエクソンスキッピング活性を示すHDSSO構造を同定した。また、相補鎖の構造と活性の関係性も明らかにし、細胞内で高い活性を示す設計指針を得ることができた。
このHDSSO技術は、LNAベースのSSOに限らず、他の核酸修飾にも応用可能と考えられる。さらに、現在注目されている脂質やペプチドを用いた薬物送達技術と併用することで、標的臓器への送達性の向上も期待される。
「本技術は筋組織に限らず、多様な標的組織におけるスプライシング制御型治療法の基盤となりうるものであり、アンチセンス核酸医薬の幅広い応用に貢献すると期待される」と、研究グループは述べている。
▼関連リンク
・東京科学大学 プレスリリース



