多疾患併存、疾患の組み合わせは集団や地域によって異なる
大阪大学は4月28日、呼吸器・免疫疾患と心血管代謝疾患の遺伝的背景の多様性を解析し、東アジア系集団と欧州系集団では、両疾患が逆方向の遺伝的相関を示すことを明らかにしたと発表した。この研究は、同大大学院医学系研究科・遺伝統計学/呼吸器・免疫内科学の山本悠司氏(博士課程)、白井雄也助教、遺伝統計学の岡田随象教授(東京大学大学院医学系研究科・遺伝情報学/理化学研究所生命医科学研究センター・システム遺伝学チーム)、東京大学大学院医学系研究科の山内敏正教授、門脇孝名誉教授(虎の門病院)らの研究グループによるもの。研究成果は、「Nature Communications」にオンライン掲載されている。
画像はリリースより
(詳細は▼関連リンクからご確認ください)
多疾患併存とは、一人の患者が複数の疾患に罹患している状態を指す。多疾患併存を持つ患者は、持たない患者と比較して生活の質や生命予後が不良であり、医療・介護負担の増加の一因となっている。
喘息や慢性閉塞性肺疾患(COPD)、関節リウマチなどの呼吸器・免疫疾患と、脂質異常症や2型糖尿病、冠動脈疾患などの心血管代謝疾患は多疾患併存を起こすことが知られていた。しかし、多疾患併存を起こす疾患の組み合わせは、集団や地域により異なることが一部の疾患で報告されている。例えば、欧州系集団の喘息患者やCOPD患者は、肥満症や脂質異常症を合併することが多く、一方、東アジア系集団のCOPD患者は痩せている傾向がある。
東アジア系集団と欧州系集団で大規模ゲノム解析を実施
呼吸器・免疫疾患や心血管代謝疾患の発症には、多くの遺伝的変異(リスク変異)が関与するため、ゲノムワイド関連解析(GWAS)によってリスク変異を同定する研究が欧米を中心に行われてきた。しかし、遺伝的変異の分布には集団間で差があるため、呼吸器-心血管代謝疾患の多疾患併存の多様性は、各集団の遺伝的変異の分布の違いに影響を受けている可能性がある。そのため、疾患同士の関係の多様性を解明することは、多疾患併存に罹患し、生活の質が低下した患者に対する個別化医療に貢献することが期待される。
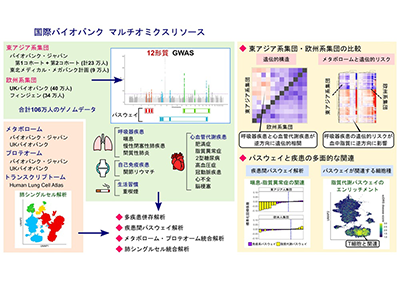
そこで今回の研究では、日本のバイオバンク・ジャパン(BBJ)の第1・第2コホートおよび東北メディカル・メガバンク計画、英国のUKバイオバンク、フィンランドのフィンジェンなどにより収集された約106万人のヒトゲノム情報を活用し、GWASを実施した。解析対象には、これら全てのバイオバンクで登録されていた呼吸器疾患(喘息、COPD、間質性肺炎)、7種の心血管代謝疾患(脂質異常症、肥満症、2型糖尿病、高血圧症、冠動脈疾患など)、免疫疾患(関節リウマチ)、重喫煙が含まれた。
呼吸器・免疫疾患と心血管代謝疾患、遺伝的リスクの関連は東アジアと欧州で正反対
まず、GWASにより集団レベルで疾患間の遺伝的な関係を解析したところ、呼吸器・免疫疾患の遺伝的リスク上昇は、東アジア系集団では心血管代謝疾患の遺伝的リスクの低下と関連することを発見した。反対に、欧州系集団では心血管代謝疾患の上昇と関連したことから、呼吸器・免疫疾患と心血管代謝疾患の遺伝的関係は集団間で多様であることが明らかになった。また、東アジア系集団では、関節リウマチの遺伝的リスク上昇が高血圧症の遺伝的リスクと関連することがわかった。
東アジア系は呼吸器・免疫疾患ありで心血管代謝疾患のリスク低下
次に、これらの遺伝子変異の疾患への影響を積算することで、各疾患のポリジェニック・リスク・スコア(PRS)を計算した。このスコアは実際の疾患発症リスクと相関することが示されており、スコアを計算することで、その人が疾患にかかりやすい遺伝的体質を持っているかどうか調べることができる。
PRSを用いて、呼吸器-心血管代謝疾患の多疾患併存あり/なしでの呼吸器・免疫-心血管代謝疾患の遺伝的関係を解析したところ、東アジア系集団では呼吸器・免疫疾患の遺伝的リスクと心血管代謝疾患の遺伝的リスクが逆方向であることがわかった。つまり、東アジア系集団では、呼吸器・免疫疾患の遺伝的リスクが上昇すると、心血管代謝疾患の遺伝的リスクは低下する。一方、欧州系集団では、呼吸器・免疫疾患の遺伝的リスク上昇が心血管代謝疾患の遺伝的リスク上昇と関連した。
遺伝的リスクの影響を受ける血中代謝物・タンパク質を特定
また、BBJの東アジア系集団とUKバイオバンクの欧州系集団の血清から測定した325個の代謝物および2,917個のタンパク質から成るプロテオームの血中濃度とPRSの関連を解析し、各疾患の遺伝的リスクが血中の分子プロファイルに与える影響を検討した。その結果、東アジア系集団では、喘息とCOPDの遺伝的リスクと脂質異常症の遺伝的リスクは血中代謝物に逆方向の影響を与えることが明らかになった。
生物学的パスウェイの多様性と共通性も明らかに
最後に、各疾患のGWASの結果に基づきパスウェイ解析を行い、それぞれの疾患と遺伝的に関連の強い生物学的パスウェイを抽出した。興味深いことに、欧州系集団では喘息の遺伝的リスクと脂質代謝パスウェイの間に明確な関連は見られなかったものの、東アジア系集団では喘息リスクが脂質代謝パスウェイの活性低下と関連する傾向があることが判明した。
一方で、免疫系と脂質代謝の両方に関連するPPARαのパスウェイは、東アジア系集団と欧州系集団に共通して逆方向の遺伝的な影響を示した。PPARαは脂肪酸の代謝に関わる一方で、T細胞におけるインターフェロンγの産生を抑制することで、炎症の抑制に関連する。これらの結果から、機能レベルで解析すると集団間で共通して多様な影響を持つ生物学的パスウェイがあることが明らかになった。
多疾患併存に対する精度の高い個別化医療の実現に期待
「今回の研究によって、多疾患併存あり/なしの両方で、呼吸器・免疫疾患と心血管代謝疾患の遺伝的関係には集団間で多様性があることが明らかになった。この結果は、多疾患併存に対する個別化医療の実施において、集団の遺伝的特徴を考慮することの重要性を示している」と、研究グループは述べている。
▼関連リンク
・大阪大学大学院医学系研究科・医学部 主要研究成果



